Jaká je ideální cílová hodnota LDL-C po prodělané akutní koronární příhodě, kterými léčebnými intervencemi ji lze dosáhnout či proč má hypolipidemická léčba stále své oprávnění v sekundární prevenci pacientů po infarktu myokardu? Tyto a další související otázky se snažili objasnit odborníci z oblasti kardiologie a lipidologie v průběhu prvního webináře cyklu Sanofi Cardio Academy, který proběhl 23. března 2022 online.
Význam a interpretace lipidogramu
To, že v praxi není LDL jako LDL, se pokoušela objasnit v prvním příspěvku věnovaném interpretaci lipidogramu MUDr. Jana Čepová, Ph.D., z Ústavu lékařské chemie a klinické biochemie 2. LF UK a FN Motol v Praze.
Smyslem hypolipidemické léčby je dosažení cílových hodnot LDL cholesterolu (LDL-C) a dalších parametrů lipidového spektra (triglyceridy, celkový cholesterol, HDL-C, non HDL-C, apolipoprotein B…). Lipidový profil se doporučuje podle současných guidelines vyšetřovat před zahájením léčby, po jejím zahájení i po dosažení cílových hodnot. Jak připomenula dr. Čepová, LDL-C je spouštěčem aterogeneze, přičemž jeho hladiny v těle lze změřit či spočítat. V souvislosti s užitím tzv. Friedewaldovy rovnice LDL-C = celkový cholesterol – (HDL + VLDL) pakupozornila na některá úskalí a možnosti úpravy tohoto výpočtu pro účely klinické praxe. Problémem je, že jednotlivé výpočty vedou k odlišným hodnotám LDL-C. Rozdíl mezi hodnotou 2,9 a 3,1 mmol/l přitom může ovlivnit rozhodnutí lékaře, zda pacientovi nasadit intenzivní statinovou léčbu. Rovněž měření LDL-C může být zatíženo nepřesnostmi, zejména u pacientů s hladinou triglyceridů nad 11 mmol/l. Ani jedna z uvedených metod tedy není referenční. Použít lze i výpočet non HDL-C, avšak pozor je třeba dát při interpretaci, kdy vysoké HDL-C již neznamená zásadní KV protekci.
Dr. Čepová připomenula také význam apolipoproteinu A, jehož snížené hodnoty ukazují mimo jiné na zvýšené riziko aterosklerózy, zvýšené hodnoty ovšem můžeme nalézat např. ve spojení se zvýšenou konzumací alkoholu. Podobně nejsou spolehlivé ani hodnoty apolipoproteinu B, který bývá snížen u hepatopatie či sepse, a naopak zvýšen u diabetes mellitus, hypotyreózy a dalších onemocnění.
U jedinců se zvýšeným rizikem kardiovaskulárních (KV) onemocnění se v současnosti doporučuje měřit i lipoprotein (a). Hodnoty nad 1 000 mmol/l přitom představují obdobné riziko jako primární familiární hypercholesterolemie, u hodnot nad 1 800 mmol/l je KV riziko shodné jako u pacientů se srdečním selháním. Pozor je třeba věnovat rovněž interpretaci hodnot u jiných etnik. Zvýšené hodnoty lipoproteinu (a) nacházíme po infarktu myokardu (až o 300 %), dále u nefropatie, renálního selhání či pokročilých nádorů. Možnosti farmakologického ovlivnění lipoproteinu (a) jsou zatím omezené, zajímavostí může být možné snížení při konzumaci mandlí.
U lipidového profilu je podle dr. Čepové třeba zohlednit biologickou intra- a interindividuální variabilitu. Výkyvy v hodnotách mají význam pro určení tzv. kritické diference.
Správná interpretace lipidogramu má význam pro identifikaci KV rizika pacienta, jeho prognózu i volbu léčebné strategie. Lékař by měl myslet na možná úskalí související s měřením a výpočtem hodnot lipidového spektra a zohledňovat individuální variabilitu v čase a mezi jednotlivým pacienty.
K dispozici je dnes i možnost měření PCSK9 v plazmě. Vytipování vhodného pacienta pro toto měření je zatím předmětem diskuze.
Léčebné cíle po infarktu myokardu
Managementu hypolipidemické léčby po infarktu myokardu (IM) se v dalším příspěvku věnoval prof. MUDr. Petr Ošťádal, Ph.D., z Kardiovaskulárního centra Nemocnice Na Homolce v Praze.
Hospitalizační mortalita na infarkt myokardu (IM) díky moderní léčbě v posledních letech klesla a pohybuje se kolem 6 %. Bohužel, i tak pacient po IM zůstává v riziku následné kardiovaskulární příhody. Do 3 let po IM cca 10 % pacientů prodělá další IM, 2 % nemocných postihne cévní mozková příhoda a celkově 5 % zemře v důsledku KV příčiny. Roční mortalita po IM se udává kolem 10 %. Pacient po akutním infarktu je tedy ve velmi vysokém riziku další KV příhody, jak uvádějí i guidelines Evropské kardiologické společnosti (ESC) a Evropské společnosti pro aterosklerózu EAS z roku 2019.
Uvedených pacientů se týkají i nové léčebné cíle. Jak upozornil profesor Ošťádal, aktuálním cílem léčby je dosažení LDL-C < 1,4 mmol/l a současně jeho redukce alespoň o 50 % oproti vstupní hodnotě. U pacientů s opakovanou příhodou během 2 let i přes léčbu maximální tolerovanou dávkou statinu lze zvážit dokonce cílovou hladinu LDL-C < 1 mmol/l. Současná guidelines reflektují téměř lineární vztah mezi hodnotou LDL-C a KV rizikem (graf 1).
Graf 1 Léčbou dosažená hodnota LDL-C ve vztahu ke KV riziku
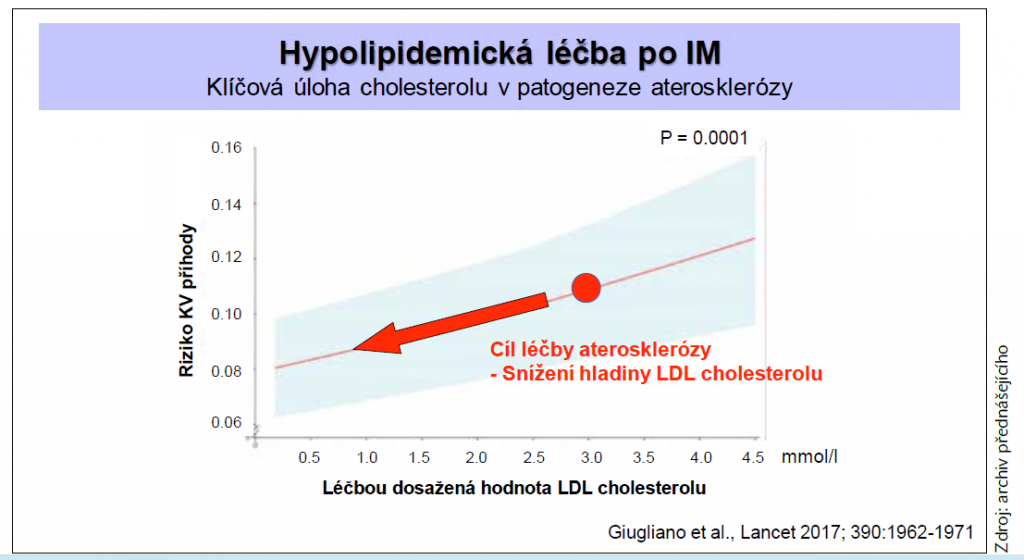
Cílem léčby aterosklerózy je dosáhnout co nejnižší hladiny LDL-C, a tím stabilizovat koronární ateromový plát – zmenšit velikost lipidového jádra, zesílit vazivovou čepičku a snížit tak náchylnost k fisuře či ruptuře plátu, jak vysvětlil prof. Ošťádal. Dále poskytl přehled výsledků významných studií s hypolipidemiky, která mohou pomoci v dosažení uvedených léčebných cílů.
Hypolipidemika s evidencí po IM v roce 2022
Studie MIRACLE, publikovaná v roce 2001, potvrdila, že intenzivní statinová léčba významně snižuje riziko KV příhod. Ve studii byl porovnávám účinek atorvastatinu proti placebu. Další studie PROVE-IT z roku 2004 porovnávala léčbu pravastatinem 40 mg vs. atorvastatinem 80 mg. Výsledky po 30měsíčním sledování ukázaly, že intenzivnější statinová léčba (atorvastatin 80 mg) po AIM vede k nižšímu výskytu KV příhod (22,4 vs. 26,3 %). Efekt ezetimibu přidaného k simvastatinu sledovala studie IMPROVE-IT z roku 2015. Po 7 letech sledování byl výskyt KV příhod nižší než v případě monoterapie statinem. Efekt ezetimibu byl přitom výraznější u pacientů s více rizikovými faktory.
V posledních letech, jak připomenul prof. Ošťádal, vstupují do popředí nová hypolipidemika, a sice ze skupiny inhibitorů PCSK9. Účinek prvního z nich, evolokumabu, hodnotila studie FOURIER publikovaná v roce 2017 u nemocných s klinicky významnou aterosklerózou, přibližně 80 % z nich prodělalo IM. Snížení LDL-C o 59 % ve skupině s evolokumabem (ve srovnání s placebem) se projevilo i v klinických výsledcích – snížení výskytu KV příhod o 15 %.
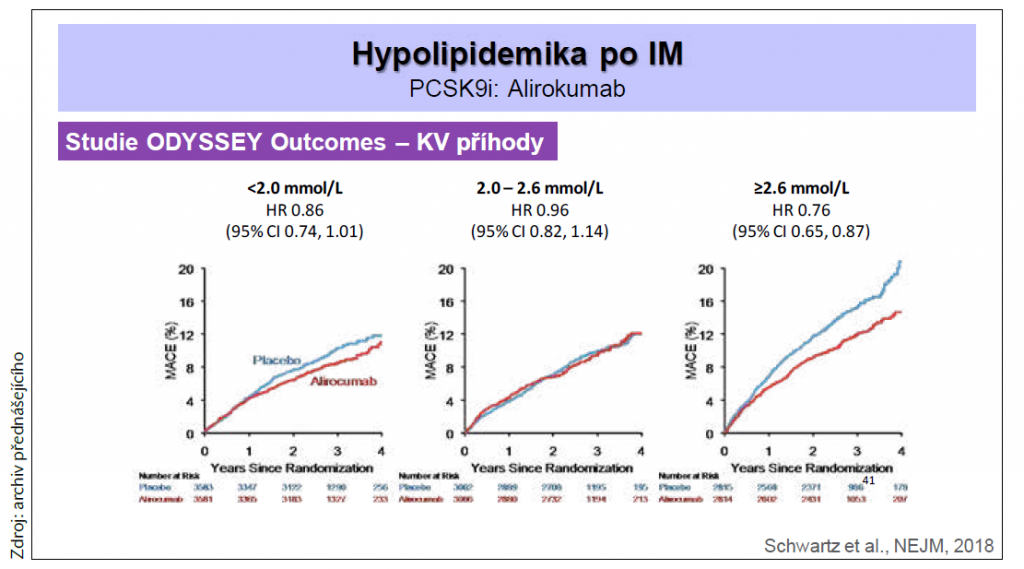
Studie ODYSSEY OUTCOMES z roku 2018 prokázala efekt dalšího inhibitoru PCSK9 – alirokumabu, který dramaticky snížil riziko KV příhod (o 15 %) u pacientů po akutním koronárním syndromu po přidání k intenzivní statinové léčbě (graf 2). V této studii byla dokonce léčba ve skupině s alirokumabem spojena s nižší celkovou mortalitou (o 15 %). Nejvýraznější efekt alirokumabu byl zaznamenán u pacientů se vstupní hodnotou LDL-C ≥ 2,6 mmol/l.
Graf 2 Redukce KV příhod po přidání alirokumabu k intenzivní statinové léčbě, data ze studie ODYSSEY OUTCOMES
V současnosti existují rovněž důkazy, že léčba inhibitory PCSK9 může stabilizovat aterosklerotické pláty. V případě alirokumabu došlo po 36 týdnech sledování k významnému zesílení vazivové čepičky koronárního plátu, jak potvrdila studie ALTAIR z roku 2020.
Strategie hypolipidemické léčby po AIM
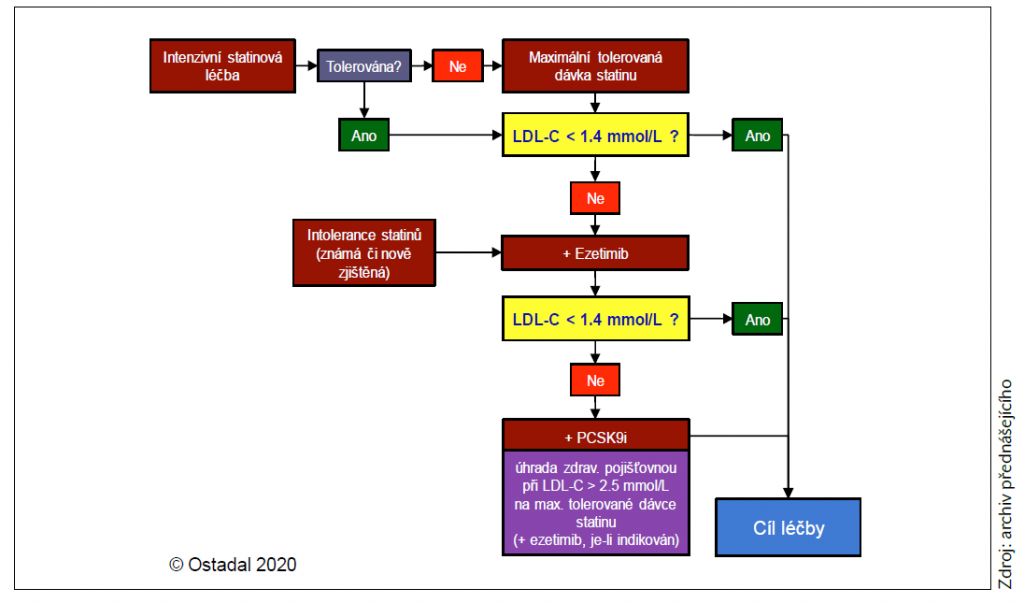
Podle současných guidelines EAS a ESC se na základě dostupné evidence doporučuje:
- intenzivní statinová léčba u všech nemocných co nejdříve po AIM,
- kontrola hladin lipidů za 4–6 týdnů po nasazení – zjištění, zda bylo dosaženo léčebného cíle,
- pokud není dosaženo léčebného cíle na maximální tolerované dávce statinu, přidat ezetimib,
- pokud není dosaženo léčebného cíle na maximální tolerované dávce statinu s ezetimibem, přidat inhibitor PCSK9.
Názorně to ukazuje schéma 1.
Schéma 1 Doporučení k hypolipidemické léčbě po IM
Instrukce pro péči po hospitalizaci
Prostor pro zlepšení péče o nemocné s akutním koronárním syndromem je podle prof. Ošťádala na úrovni pacienta, nemocnice i ambulancí. Pacient musí před propouštěním z nemocnice obdržet veškeré potřebné informace, zejména co se týče významu nízké hladiny LDL-C pro další prognózu. Pacient by měl znát hodnotu cílové hladiny svého LDL-C a usilovat o to, aby jí skutečně dosáhl. Pomoci mohou jak informace na webu a mobilní aplikace, tak i tradiční papírové informační brožury. Z nemocnice by měl být pacient také propuštěn s jasným doporučením v propouštěcí zprávě, jak postupovat v případě hypolipidemické léčby a kdy kontrolovat lipidogram. Ve zprávě by dále mělo být uvedeno, že pacientovi byla nasazena intenzivní statinová léčba, eventuálně vysvětleno, proč se tak nestalo. V případě nedosažení cílových hodnot LDL-C při dodržení všech doporučení by měl ošetřující lékař kontaktovat PCSK9i centrum s cílem přidání PCSK9 inhibitorů. Návrh Vzorový text doporučení do propouštěcí/překladové zprávy nemocného po IM je k dispozici k volnému stažení na stránkách České kardiologické společnosti (kardio-cz.cz). V lednu 2022 byla také publikována aktualizovaná verze souhrnu doporučení pro dlouhodobou léčbu po IM v časopise Cor et Vasa.
Jak shrnul prof. Ošťádal, pečlivě vedená sekundární prevence může významně snížit pravděpodobnost vzniku další KV příhody po IM. Intenzivní hypolipidemická léčba přitom patří v tomto ohledu mezi nejúčinnější nástroje, které máme k dispozici.
Kdy a proč podat inhibitory PCSK9
Poznatkům o PCSK9i v klinické praxi se věnoval prim. MUDr. Jiří Veselý z Kardiologické ambulance Edumed v Broumově. Problematiku shrnul v odpovědích na čtyři hlavní otázky:
1. Není péče o pacienty po IM již desetiletí vyřešený problém?
Jak bylo výše uvedeno, riziko recidivy IM je nejvyšší v prvním roce po propuštění z hospitalizace. K postižení přitom dochází na různých místech cévního řečiště. Oprava cévy po IM stentem je podle prim. Veselého oprava „velice hrubá“, a pacienta je proto třeba patřičně medikamentózně zajistit.
2. Má hypolipidemická léčba po IM význam i v době nových stentů a nových antitrombotických strategií?
Jednou z významných prací, která přispěla k odpovědi na tuto otázku, je skandinávská studie autorů Schuberta a kol. z roku 2020, která sledovala vliv intenzivní statinové léčby na LDL-C po IM. Studie jednoznačně potvrdila pozitivní vliv statinové léčby na dlouhodobou prognózu pacientů po IM.
3. Máme v hypolipidemické léčbě po IM v roce 2022 ještě nějaké rezervy?
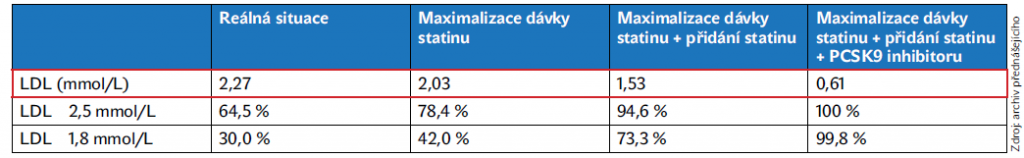
Průzkumy EUROASPIRE, jejichž výsledky prim. Veselý prezentoval, porovnávají prognózu nemocných po IM v jednotlivých zemích. Data z EUROASPIRE IV z roku 2016 ukazují, že v ČR dostalo statin po propuštění z nemocnice 94 % pacientů. Bohužel, během pandemie koronaviru došlo přibližně k 20% poklesu preskripce statinů. Ze studie EUROASPIRE V vyplynulo, že hodnot LDL-C ≤ 1,8 mmol/l dosáhly s léčbou necelé dvě třetiny pacientů. Navíc EUROASPIRE III naznačuje, že pokles snižování LDL-C je v ČR velmi pomalý (průměrně 2,55 mmol/l v období 2006–2007 a 2,02 mmol/l v období 2016–2017). Cílových hodnot LDL-C < 1,8 mmol/l dosahovalo ještě v roce 2017 pouze 48 % pacientů po IM. Výsledky průzkumu současně potvrzují významnější vliv vysokých dávek statinu na redukci LDL-C. Při využití kombinace s ezetimibem a inhibitory PCSK9 pak lze dosáhnout cílové hladiny LDL-C < 1,8 mmol/l téměř u 100 % pacientů, jak ukazuje tabulka 1.
Tabulka 1 Potenciální efekty navýšení léčby, data ze studie Euroaspire III
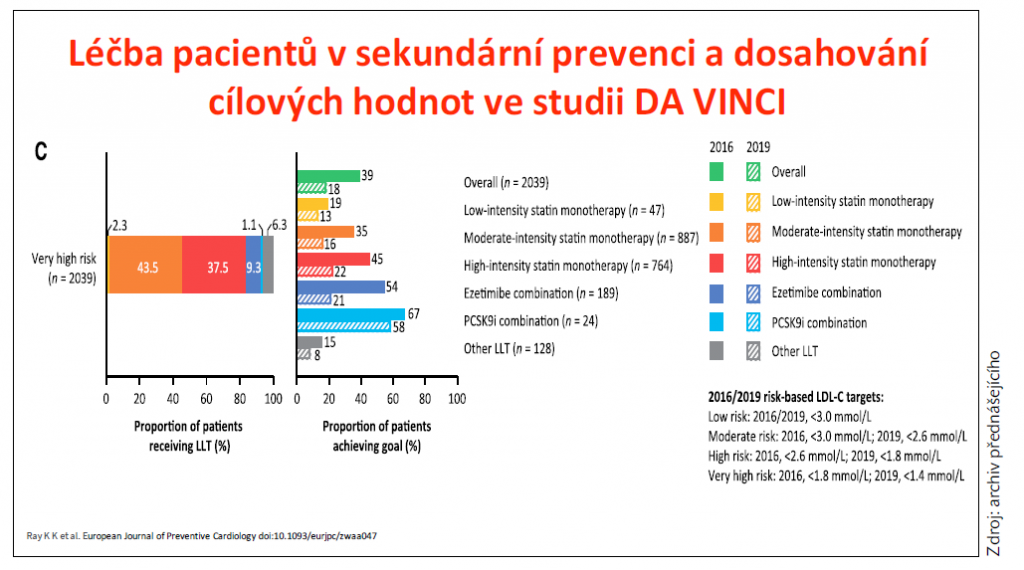
Realita je bohužel podle prim. Veselého odlišná, což ukazují i výsledky recentní observační studie DA VINCI, která monitorovala dosahování cílových hodnot LDL-C v sekundární prevenci po IM. Ze studie vyplynulo, že nově cílových hodnot < 1,4 mmol/l dosahovalo i při kombinaci statinu s ezetimibem pouze 20 % pacientů. Po přidání PCSK9i dosáhly cílové hodnoty dvě třetiny pacientů (graf 3). Uvedená data ukazují na možnost budoucího širšího využití PCSK9i u pacientů po IM.
Graf 3 Dosahování cílových hodnot LDL-C v sekundární prevenci, data ze studie DA VINCI
4. Jak můžeme zlepšit péči?
V návaznosti na již zmíněný dokument „Stručný souhrn doporučení pro dlouhodobou péči o nemocné po IM“ dr. Veselý znovu vyzdvihl důležitost kontroly lipidogramu 4–6 týdnů po IM. Současně poukázal na úskalí úhradových kritérií, na jejichž podkladě se při nedosažení cílové hodnoty standardně přidává ke statinu jako další lék ezetimib, ačkoli v řadě případů by bylo vhodnější podat rovnou PCSK9i. Doporučení k preskripci lze nalézt ve „Společném stanovisku odborných společností k předepisování PCSK9i“ z roku 2018. V tomto doporučení autoři obhajují přidání PCSK9i ke statinové léčbě s vynecháním ezetimibu, pokud po 8 týdnech léčby zůstává hladina LDL-C více než 50 % nad stanovenou cílovou hodnotou.
Další díly z cyklu webinářů je možné sledovat na: cardioacademy.cz
MUDr. Andrea Skálová
