Indikace imunoterapie, mechanizmus jejího působení a nežádoucí účinky se výrazně liší od jiných modalit onkologické léčby, které jsou využívány již po desetiletí. Imunoterapie se v poslední dekádě stala plnohodnotným pilířem léčby, který významně mění prognózu pacientů. V článku jsou shrnuty historické souvislosti, základní principy, aktuálně využívané přípravky a jejich indikace a základní přehled nežádoucích účinků.
V organizmu údajně vzniká denně až několik trilionů změn DNA, kterým říkáme mutace. Absolutní většinu z nich tělo opraví či poškozené buňky eliminuje. Někdy se však vyskytne mutace, kterou buňka nevyhodnotí jako patologickou a imunitní systém ji nerozpozná a neeliminuje. Důvod může být na straně imunitního systému (oslabení/vyčerpání imunitního systému, např. chronickou virovou infekcí, jako HIV, HPV) či na straně tumoru (produkce látek, které tlumí reakci imunitního systému přímo v nádorové tkáni). Existují nádory, které již ve svém mikroskopickém obraze obsahují množství imunitních buněk (dokonce ve starší patologické terminologii měly i specifické názvy, jako např. lymfoepiteliom, Hodgkinova choroba s lymfocytární převahou apod.), a přesto bují. Dnes se nádory s velkou leukocytární infiltrací popisují jako horké („hot“).
Předpokladem úspěšné léčby nádorů je tedy funkční imunitní systém. Nicméně i ten potřebuje specifickou stimulaci, aby mohl působit protinádorově. Nádory mají množství mechanizmů, jak se před imunitním systémem „schovávat“: maskují část svých antigenů a produkují látky (ligandy), které blokují aktivační receptory T lymfocytů. Právě aktivace vlastní imunitní reakce tvoří základ aktuálně používané imunoterapie.
Historie imunoterapie
Snahy o modulaci imunitního systému sahají do dávnověku. Některé interpretace egyptských hieroglyfů mluví o spontánním vymizení tumorů u pacientů s vysokou horečkou, podobné nálezy byly zaznamenány i řeckým lékařem Galénem. O cílenou modifikaci se v 18. století poprvé pokusili němečtí lékaři, kteří dosáhli zmenšení nádoru inokulací bakterií působících erysipel. První ucelený soubor takové léčby prezentoval v roce 1891 William Bradley Coley, který aplikoval „erysipelózní infekci“ k léčbě kostních nádorů. Další zkoumání Coleye pak zahrnovalo injekce bakteriálních směsí Streptococcus pyogenes a Serratia marcescens k léčbě různých zhoubných nádorů a tento lékař popsal až kolem 1 000 případů dosažení regrese či remise onemocnění. Vzhledem k tomu, že mechanizmus působení nebyl jasný, tato metoda léčby nebyla obecně přijata lékařskou veřejností. Teprve o 50 let později, kdy byly prvně vysvětleny základní imunitní mechanizmy a popsány první cytokiny, začala éra „moderní imunoterapie“. V roce 1945 byl objeven interferon, 1967 T lymfocyty, 1973 dendritické buňky a 1975 NK lymfocyty, v 80. letech se objevily první vakcíny cílící na specifický antigen. S každým takovým objevem se současně zkoumalo využití nových poznatků v onkologii.
Mechanizmy působení imunoterapie
Pasivní imunoterapie
Aplikace protilátek působících proti antigenům nádorových buněk (monoklonální protilátky, konjugáty protilátek s cytostatikem nebo aktivním radioizotopem). Internalizací receptoru s navázaným funkčním ligandem se následně spouští kaskáda nitrobuněčných reakcí vedoucích k zániku buňky.
Aktivní imunoterapie
Lokální
- Např. instilace BCG vakcíny do močového měchýře u povrchových nádorů močového měchýře; tímto je stimulována nespecifická povrchová zánětlivá slizniční reakce v močovém měchýři, která současně působí protinádorově.
- Devitalizace – metoda, kdy je chirurgicky proveden podvaz cév nádoru, ale samotný nádor je v těle ponechán; tento postup předpokládá, že akutní hypoxie v nádoru a nekróza nádorových buněk vyvolá zánětlivou reakci a případné nové antigeny spustí protinádorovou imunitní reakci.
Systémová
- Interferony – cytokiny protivirové obrany, jejichž sekrece je stimulována virovou infekcí. Iatrogenní podání vysokých dávek interferonů snižuje translaci RNA na výsledné efektorové proteiny. Aplikace interferonu α byla v minulosti využívána v léčbě maligního melanomu a nádoru ledvin s účinností cca 10–20 % a významnými nežádoucími účinky.
- Interleukiny – cytokiny produkované leukocyty zajišťující interakci leukocytů mezi sebou, některé jsou prozánětlivé, jiné zánětlivou reakci tlumí. Prozánětlivé byly využívány léčebně v onkologii ve stejných indikacích a s podobnými výsledky jako u interferonů.
- Vakcíny z dendritických buněk specifických pro nádorové antigeny odebraných přímo od pacienta – z nádoru pacienta jsou izolovány antigeny, kterými jsou ex vivo aktivovány dendritické buňky pacienta získané z odběru periferní krve. Ty jsou pak podány pacientovi zpět, aby stimulovaly protinádorovou imunitní reakci. Jsou využívány u nádorů prostaty, nádorů prsu, nádorů vaječníku a dětských nádorů
- Aktivace buněčné smrti
- Aktivace Fc receptoru NK buněk– rituximab, alemtuzumab.
- Aktivace T lymfocytů vazbou na CTLA4 receptor (koreceptor stimulovaný dendritickou buňkou) – ipilimumab.
- Blokace kontrolních bodů imunitní reakce – rušení inaktivace T lymfocytů cestou programmed death receptor 1 (PD-1). Nádorové buňky produkují a exprimují ligand pro PD receptor (PD-L1) na T lymfocytech, a tím inaktivují imunitní reakci spouštěnou T lymfocyty; protilátky proti receptoru PD-1 nebo ligandu PD-L1 zamezují vazby ligandu na PD receptor T lymfocytu, a umožňují tak aktivaci T lymfocytu.
- Anti PD1 – nivolumab, pembrolizumab, cemiplimab.
- AYnti PD-L1 – atezolizumab, durvalumab, avelumab,
- Blokace LAG-3 (lymfocytární aktivační gen – 3) – receptor spolupracující na inhibici imunitní reakce; účinnost inhibitoru LAG3 (relatlimab) je v současnosti testována v klinických studiích v kombinaci s antiPD-L1.
- Objevují se nové molekulární cíle a je zkoumán případný terapeutický přínos. Jedná se například o inhibitor indoleamine 2,3 deoxygenázy 1 (IDO1), modifikovaný interleukin 2, superagonistu interleukinu 15 a další.
Současné využití imunoterapie
Výčet indikací současně využívaných přípravků je obtížný, protože se dynamicky mění (tabulka 1). Imunoterapie se postupně využívá v léčbě celé řady malignit, u některých se jedná o základní modalitu léčby, u jiných o léčbu doplňkovou, v některých indikacích se používá monoterapie antiPD-L1 či anti PD-1, v jiných v kombinaci s antiCTLA4 či chemoterapií. Indikace užití jsou široké, úhrady výrazně skromnější a v konkrétních indikacích jsou velice přesně stanoveny podmínky úhrady. Schválené indikace a platné úhrady pojišťovnami se ne vždy shodují.
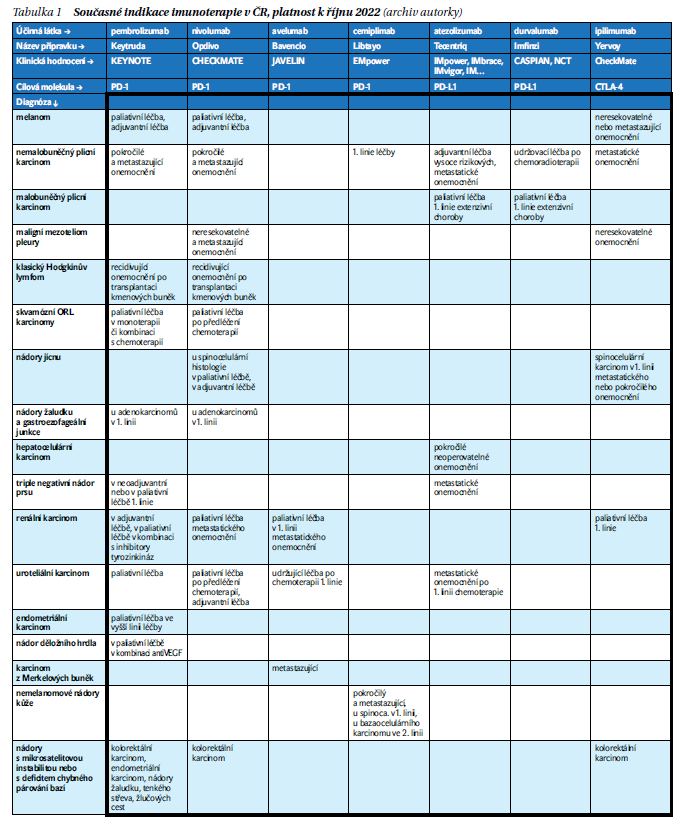
U některých diagnóz byl přínos imunoterapie prokázán nezávisle na přítomnosti prediktivního faktoru/znaku, příkladem je léčba melanomu, metastatického světlebuněčného adenokarcinomu ledviny či např. v paliativní léčbě spinocelulárního karcinomu hlavy a krku. U jiných diagnóz je nutný průkaz prediktivního znaku v nádoru či nádorovém stromatu. Takovým prediktivním znakem může být:
- průkaz mikrosatelitové instability tumoru (MSI) či vrozeného defektu tzv. mismatch repair systému (Lynchův syndrom);
- průkaz exprese PD-L1 v nádoru, a to buď jako parametr TPS, nebo CPS;
- Tumor Proportion Score (TPS) – podíl PD-L1 pozitivních nádorových buněk k počtu všech nádorových buněk;
- Combined Positive Score (CPS) – podíl všech PD-L1 pozitivních buněk k počtu všech buněk v nádoru vč. nádorových buněk, lymfocytů, makrofágů.
Nežádoucí účinky léčby
Nežádoucí účinky (NÚ) vycházejí z aktivace imunitního systému a připomínají autoimunitní reakce či choroby. U většiny pacientů bývají mírné, ale mohou se objevit i velmi závažné a život ohrožující komplikace. Obecně léčba NÚ imunoterapie zahrnuje pulzní podání kortikoidů, které ruší efekt imunoterapie, s následnou postupnou redukcí dávky kortikoidů a po úpravě stavu opět nasazení onkologické léčby. Výrazné či závažné nežádoucí účinky si mohou vynutit trvalé přerušení imunoterapie a nasazení nejen kortikoidů, ale i dalších imunomodulačních léků (infliximab, mykofenolát mofetil). V současnosti existují podrobná doporučení onkologických společností, jak postupovat v případě podezření na NÚ imunoterapie, jak léčit příslušný stupeň toxicity a doporučení pro případné pokračování v léčbě.
K nežádoucím účinkům imunoterapie patří:
- chřipkovité potíže, bolesti kloubů, bolesti hlavy, pokles výkonnosti;
- svědění kůže, dermatitidy, vitiligo, bulózní pemfigoid, akneiformní exantém, alopecie, sklerodermie;
- endokrinopatie, nejčastěji tyroiditida (v úvodu tyroiditida, poté hypotyreóza), dále také hypofýza, adrenální insuficience, pankreatitida, diabetes mellitus 1. typu;
- hepatopatie a hepatitida;
- enterokolitida, kolitida;
- intersticiální pneumonitida, sarkoidóza;
- myokarditida, kardiomyopatie, myokardiální fibróza;
- neuropatie, myasthenia gravis, encefalitida, aseptická meningitida, syndrom Guillaina–Barrého;
- intersticiální nefritida;
- artritida, artralgie, polymyalgie;
- oftalmopatie (uveitida, blefaritida, keratitida).
Může být obtížné rozpoznat počínající toxicitu a rozlišit, zda se jedná o komplikaci chemoterapie či imunoterapie (pokud jsou podávány současně), případně o progresi samotného onkologického onemocnění.
Závěr
V současné době je imunoterapie čtvrtým pilířem onkologické léčby společně s chirurgií, chemoterapií a radioterapií. Díky dobré toleranci a často dlouhodobým efektům se stává významným hráčem, který u některých diagnóz zcela změnil pravidla hry a významně zlepšil prognózu onkologických pacientů.
