Spondyloartritidy (SpA) jsou zánětlivá, revmatická, progresivní onemocnění, která postihují páteřní struktury, periferní klouby, šlachové úpony a další perikloubní tkáně. Kromě těchto skeletálních projevů mají i časté extraskeletální manifestace, mezi něž patří akutní přední uveitidy, idiopatické střevní záněty a psoriáza. Vyskytují se také četné komorbidity. Ty jsou definovány jako projevy, které přímo s mechanizmem choroby nesouvisí, ale vyskytují se při SpA častěji než v běžné populaci. U SpA jsou nejčastější komorbidity častější infekce, osteoporóza, zvýšené kardiovaskulární riziko a onemocnění ledvin.
Z výše uvedeného vyplývá fenotypická pestrost SpA. Pro úspěšnou léčbu je nutná včasná a přesná diagnóza, komplexní popis choroby včetně všech příznaků, vyhodnocení aktivity SpA a eventuální výskyt komorbidit.
Klasifikace a diagnostika SpA
Klasifikovat SpA je možné dvojím způsobem. První je klasický způsob podle jednotlivých diagnóz. Pokud je toto možné, jistě je to optimální.
Podle této starší klasifikace rozeznáváme:
- ankylozující spondylitidu,
- psoriatickou artritidu,
- reaktivní artritidu,
- artritidu asociovanou s idiopatickými střevními záněty,
- juvenilní idiopatickou artritidu HLA-B 27 pozitivní,
- nediferencovanou spondyloartritidu.
Zhruba posledních 15 let se více užívá klasifikace SpA podle kritérií výzkumné skupiny ASAS. Jde o kritéria klasifikační, ale často se používají jako diagnostická. Tato kritéria primárně klasifikují SpA jako převážně axiální (sakroiliitida, spondylitida) nebo převážně periferní. Představitelem periferních SpA je psoriatická artritida a reaktivní artritida.
Nová kritéria
Pro formy postihující převážně páteř se etabloval název axiální spondyloartritidy (axSpA). Axiální spondyloartritidy se dělí na tzv. formy radiografické a non-radiografické. Radiologické formy SpA musí mít průkaznou sakroiliitidu (bilaterálně II. st., nebo unilaterálně III. st.) a splňují vlastně Newyorská kritéria pro ankylozující spondylitidu. Určitou novinkou je tedy jednotka tzv. non radiografické axSpA. I když od publikace konceptu axSpA uplynulo již více než 10 let, je stále možné hovořit o novince (nr-axSpA), protože do běžné klinické praxe a zvláště v oborech mimo revmatologii proniká stále nedostatečně. Hlavním smyslem nových kritérií bylo pojmenovat, klasifikovat a léčit stavy vysoce podezřelé ze spondyloartritidy, které ale ještě nemají průkaznou sakroiliitidu na rentgenovém snímku. Zpoždění v diagnóze od prvních příznaků (obvykle bolesti v dolních zádech) se uvádělo až 9 let, což je nyní zvláště v době dostupné účinné léčby neakceptovatelné. Zásadní technickou pomůckou pro diagnostiku axSpA se stala magnetická rezonance sakroiliakálních kloubů (MRI SI), která umí detekovat zánět SI kloubů ještě před rozvojem rentgenově průkazné sakroiliitidy. Zásadním nálezem na MRI je přítomnost otoku kostní dřeně (bone marrow edema – BME), který však musí mít určitou velikost, lokalizaci a být přítomen ve více vrstvách (obrázek 1). Nově se mezi diagnostické morfy řadí i eroze na SI kloubech. Interpretace nálezů na MRI SI kloubů však není jednoduchá a vyskytují se falešně pozitivní i negativní nálezy. Kostní edém byl nalezen u části pacientů bez spondyloartritidy, např. v graviditě, u silně obézních osob nebo u sportovců po velkém výkonu.
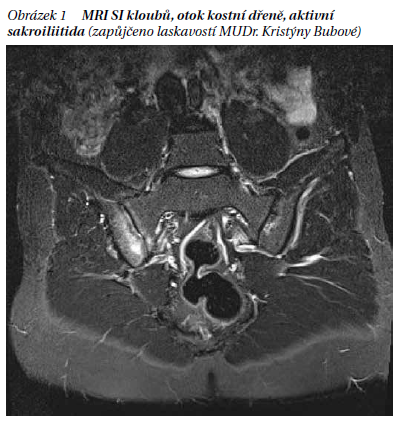
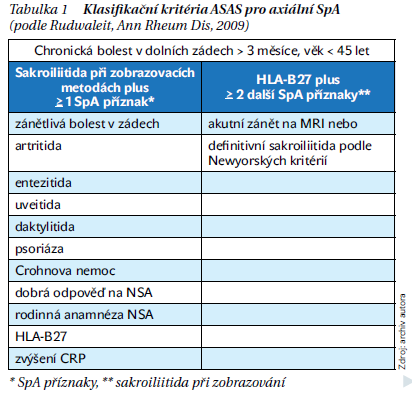
Platí tedy, že nález na MRI je nutné vždy hodnotit v kontextu klinického a laboratorního nálezu. Dalšími dvěma pilíři klasifikace SpA je zařazení antigenu HLA-B27 a nové definice zánětlivé bolesti v dolních zádech. Kritéria ASAS jsou uvedena na v tabulce 1. Klasifikaci SpA je možné udělat jednak v tzv. zobrazovací větvi, když je nález sakroiliitidy na zobrazovacích metodách + 1 specifický příznak, nebo v tzv. klinické větvi, když není nález na žádné zobrazovací metodě + 2 specifické příznaky (obrázek 2). V klinické praxi se více používá zobrazovací větev, která má při podobné specificitě asi dlouhodobě větší specificitu.
Radiografická a non-radiografická forma SpA
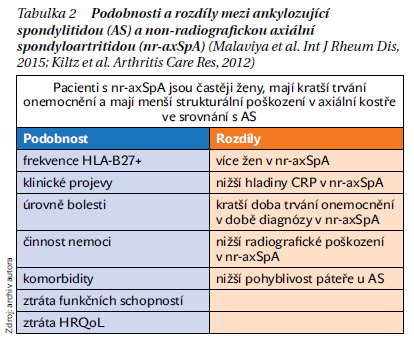
Koncepčně byla zpočátku považovaná non-radiografická forma SpA za časnou formu SpA. Dlouhodobé kohortové studie však ukázaly, že přechod nrSpA do radiografické formy je relativně pomalý a pohybuje se kolem 15 % během 2 let. Zdá se, že někteří pacienti neprogredují do radiografické formy vůbec a zůstávají ve formě nr-axSpA, možná i celoživotně. Aktuálně se tedy uznává, že existují dvě formy axSpA (radiografická a non-radiografická), které mají některé podobné a některé odlišné rysy, jak je uvedeno v tabulce 2. Důležité je, že bylo zjištěno, že aktivita a klinická závažnost obou forem SpA jsou obdobné a biologická léčba je možná u obou forem onemocnění. Otázkou tedy zůstává, zda je nutné v ordinaci běžné klinické praxe vždy definovat přesně, zda jde o radiografickou či non-radiografickou formu, zvláště pokud víme, jaké jsou problémy při popisu SI kloubů jak na rtg, tak MRI. Zatímco pro vlastní klinické rozhodování o indikaci biologické léčby to význam nemá, z regulatorních důvodů ano, protože regulační agentury (FDA, EMA, SÚKL) zatím vždy vyžadovaly u jednotlivých preparátů klinické randomizované studie u obou forem onemocnění.
Indikační kritéria pro biologickou léčbu axSpA
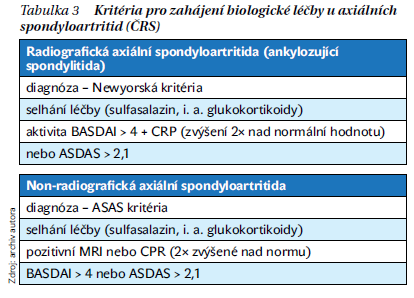
Prahová kritéria pro biologickou léčbu aktivity jsou pro obě formy axSpA definována v jednotlivých státech odlišně. Nově byla definována také v loňském roce publikovaných Doporučeních České revmatologické společnosti (ČRS) (tabulka 3). Je ale nutné konstatovat, že v tento moment (únor 2022) zatím nebyla uvedená kritéria oficiálně akceptována SÚKL ani v úhradové vyhlášce pojišťoven.
Hlavní změny proti starším Doporučením ČRS
Prvním rozdílem je, že nověji je silně doporučováno používat pro hodnocení aktivity index ASDAS, který integruje v sobě jak subjektivní symptomy pacienta, tak laboratorní ukazatel (CRP). Index ASDAS totiž lépe koreluje s rentgenovou progresí axSpA než izolovaně CRP a BASDAI. Prahovou hodnotou pro zahájení biologické léčby je hodnota ASDAS více než 2,1. Pomocí kalkulátoru v počítači či mobilu lze index ASDAS zkalkulovat během méně než 5 minut. Druhou změnou jsou indikační kritéria pro nr-axSpS. Zde jsme akceptovali Doporučení EULAR, která pro indikaci biologické léčby vyžadují buď přítomnost aktivní sakroiliitidy na MRI, nebo zvýšené CRP. Ve starších českých kritériích bylo nutné simultánní splnění obou podmínek, podle nových pak stačí splnění jedné podmínky. Reaguje to na často zmiňovaný fakt, že i při výrazné klinické aktivitě SpA bývají normální reaktanty akutní fáze. Zvýšení CRP je definováno jako 2× nad normu, což reflektuje fakt, že se používají různé metodiky k určení CRP s jinými referenčními hodnotami. To, co zůstává stejné ve starších i v nových kritériích, je definice selhání konvenční léčby axSpA (edukace, cvičení, NSA, i.a. glukokortikoidy u monoartritidy či monoentezitidy, sulfasalazin u polyartritidy).
Monitorování aktivity
Kromě hodnocení aktivity axSpA pro vlastní indikaci biologické léčby je nutné i monitorování aktivity v rámci odpovědi na léčbu. Nově se doporučuje nikoliv hodnotit určitou změnu v aktivitě proti výchozí hodnotě, ale dosažení určitého cíle podle konceptu léčba k cíli (T2T). Odpověď na léčbu se doporučuje hodnotit zpočátku v průběhu prvního roku léčby v tříměsíčních intervalech, později v intervalech 6 měsíců. Po 3 měsících by měla být patrná určitá příznivá odpověď na léčbu, po 6 měsících by mělo být dosaženo cíle léčby. Optimální je dosažení remise, definované jako ASDAS < 1,3, nebo alespoň stavu nízké aktivity (ASDAS < 2,1). Je však akceptabilní použít i starší definice stavu nízké aktivity, která obsahuje BASDAI < 4, normální CRP a názor revmatologa. Monitorování strukturální progrese je v běžné klinické praxi obtížné. Nelze ho dát povinně, ale jako vhodné určitě. V rutinní praxi se používá klasický rtg SI kloubů a celé páteře. Interval pro hodnocení progrese má být nejméně 2 roky a pro numerické hodnocení se používá nejvíce modifikované Stokesovo skóre (převážně pro výzkum a lékové studie).
Strategie léčby
Strategie léčby axSpA v Doporučeních ČRS v podstatě odpovídají strategii EULAR a jsou na obrázku 2. Ve fázi I je vhodné u všech pacientů provést edukaci, v jejímž rámci je zdůrazněno motivování pacientů k pravidelnému cvičení, zdravý životní styl a přestat kouřit. Velmi se osvědčuje zařadit na začátku instruktážní cvičení v rámci specializovaného zařízení. I později je vhodné kombinovat domácí cvičení s občasným skupinovým cvičením pod dohledem specializovaného ergoterapeuta.
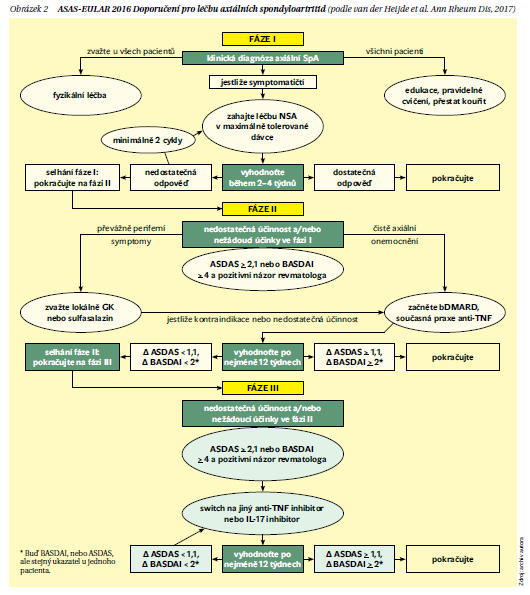
Jestliže jsou pacienti symptomatičtí, je vhodné podat nesteroidní antirevmatika (NSA). Doporučuje se podávat je v maximální možné dávce nejméně 4 týdny. Pokud není efekt po 2 týdnech, tak zkusit další NSA. Zde vyhodnotíme účinnost fáze I, a pokud hodnotíme jako selhání fáze I pro nedostatečný efekt nebo nežádoucí účinky, přistupujeme k fázi II. Jako nedostatečný efekt hodnotíme, pokud je aktivita vyšší než ASDAS 2,1 nebo BASDAI ˃ 4 a je pozitivní názor revmatologa. Na začátku fáze II posoudíme, zda má pacient periferní projevy, nebo jde o čistě axiální formu. Pokud má periferní projevy, je rozhodující, zda jde o monoartritidu či maximálně oligoartritidu, kdy provádíme lokální obstřik glukokortikoidy. Pokud jde o polyartritidu, podáváme sulfasalazin, a to v dávce 3 g minimálně po dobu 3–6 měsíců. Efekt fáze II vyhodnotíme po 12 týdnech. Pokud došlo ke zlepšení ASDAS o více než 1,1 nebo BASDAI o ˃ 2, hodnotíme jako úspěšnou léčbu a pokračujeme, pokud je změna ASDAS < 1,1 nebo BASDAI < 2, pak hodnotíme jako selhání léčby. Indikována je změna biologické léčby (switch) na jiný biologický lék.
Zatím nebylo objektivně prokázáno, zda je účinnější switch na biologický lék se stejným či jiným mechanizmem účinku. Pokud je pacient dlouhodobě, tzn. nejméně 6 měsíců a 2 kontroly po sobě ve stavu remise, je možné uvažovat o detrakci léčby. Detrakce může být prováděna buď prodloužením intervalu, nebo snížením dávky. Jako příklad je možné podat snížené dávky etanerceptu 25 mg týdně, nebo původní dávku 50 mg s. c. za 2 týdny. Nejméně polovina pacientů udržuje na detrahované dávce žádoucí efekt, u části pacientů je nutné se vrátit na původní dávku. Vysazení bDMARD se nedoporučuje, protože velké množství pacientů v řádu několika měsíců relabuje.
Biologické léky pro léčbu axSpA
Počet léků s registrací indikace axSpA se značně rozšířil (tabulka 4).
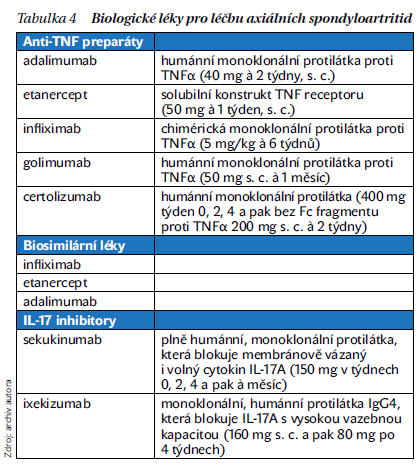
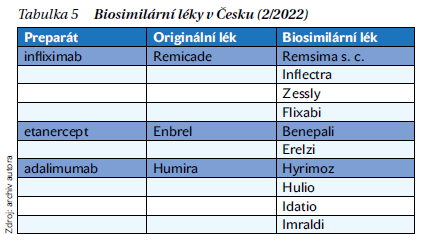
V současné době je k léčbě axSpA indikováno 5 anti-TNF preparátů: infliximab, etanercept, adalimumab, golimumab a certolizumab. Všechny mají indikaci ankylozující spondylitidy (radiografické axSpA), s výjimkou infliximabu pak také u nr-axSpA. Po vypršení patentové ochrany byly vyrobeny a po splnění přísných regulatorních podmínek akceptovány biosimilární léky k referenčnímu infliximabu, etanerceptu a adalimumabu (tabulka 5). Prokázaly stejnou účinnost a bezpečnost jako referenční léky a mají stejné indikace. Switch z originálního biologického léku na biosimilární je bezpečný a účinný. Měl by ale vždy být prováděn za souhlasu pacienta v ordinaci lékaře s řádnou edukací pacienta. Novinkou je subkutánní forma biosimilárního infliximabu CT-P13 (Remsima), která prokázala vyšší účinnost než forma intravenózní. Nověji byly zaregistrovány biologické léky s jiným mechanizmem účinku, konkrétně inhibitory IL-17. V běžné klinické praxi jsou dostupné sekukinumab a ixekizumab. Jako první biologický lék může být zvolen buď anti-TNF preparát, nebo alternativně IL-17 inhibitor. Účinnost anti-TNF a anti-IL-17 léků na axiální a periferní kloubní a entezitickou aktivitu je obdobná. IL-17 inhibitory jsou pravděpodobně účinnější na psoriázu, takže pokud je přítomen u SpA výraznější kožní syndrom, jsou lékem první volby. Naopak IL-17 inhibitory nejsou účinné na idiopatické střevní záněty, nebo je dokonce zhoršují. Rovněž pro možné přítomné uveitidy mají silnější evidenci o účinnosti především monoklonální anti-TNF protilátky. Na přítomný střevní zánět také není účinný etanercept.
Pacient se spondyloartritidou a akutní přední uveitidou
Akutní přední uveitida (AU) je nejčastější extraskeletární manifestací spondyloartritid. V epidemiologické studii ukazuje výskyt 30–40 % pacientů s SpA. Většina těchto pacientů má pozitivní antigen HLA-B27. Terapie anti-TNF preparáty snižuje výskyt exacerbací AU v porovnání před léčbou biologickými preparáty. Nejvíce dat je o adalimumabu, když se uvádí redukce až u 80 % pacientů. Pravděpodobně stejně účinné jsou ostatní monoklonální protilátky (infliximab, certulizumab, golimumab). Účinnost etanerceptu v prevenci AU může být poněkud nižší. Žádný efekt nebyl zatím zjištěn u IL-17 inhibitorů.
Pacient s axSpA a idiopatickými střevními záněty
Výskyt idiopatických střevních zánětů (IBD) u spondyloartritid se udává 5–10 %. Z druhého úhlu pohledu u pacientů s IBD se vyskytují příznaky v rozmezí 20–40 %.
Muskuloskeletální manifestace SpA lze rozdělit na dva odlišné subsety: první skupinu tvoří pacienti s axiálním postižením (včetně sakroiliitidy, nebo bez sakroiliitidy) a druhou skupinu pak tvoří pacienti s výhradně periferním postižením. Periferní postižení se dále dělí na podskupinu s oligoartritidou (artritida méně než 4 kloubů) a podskupinu s polyartritidou (postiženo 5 a více kloubů).
Enteropatické SpA (eSpA) představují mulutiorgánové systémové onemocnění a pacient by měl vždy být v týmové péči revmatologa a gastroenterologa.
Nesteroidní antirevmatika nejsou při léčbě příliš vhodná, protože mohou zhoršovat průběh střevního onemocnění. Při aktivní formě SpA a IBD v remisi je možné aplikovat krátkodobě NSA, a to nejlépe COX-2 selektivní (celekoxib).
Sulfasalazin může být vhodným lékem u nemocného s axSpA a mírnou formou Crohnovy nemoci, kde může být výhodnější než mesalazin, protože sulfasalazin ovlivňuje jak střevní zánět, tak periferní artritidu. Sulfasalazin se podává v dávkách 3–4 g denně.
Lékem volby eSpA jsou inhibitory TNFα, protože ovlivňují příznivě jak kloubní, tak střevní syndrom. Aplikace systémové léčby se řídí podle doporučení odborných společností a koordinace mezi gastroenterologem a revmatologem je nutná. Nejvhodnějšími léky jsou infliximab a adalimumab.
Osteoporóza u nemocných SpA
Osteoporóza je jedna z nejčasnějších komorbidit u SpA, ale údaje o jejím výskytu v literatuře velmi kolísají a pohybují se až v rozmezí 18–62 %. Prevalence vertebrálních fraktur ve studiích velmi kolísá (4–41 %). V klinické praxi je asi jen jedna čtvrtina vertebrálních fraktur diagnostikována. Relativní riziko vertebrálních fraktur u SpA je 7,7. Na možnost vertebrální fraktury je vždy důležité myslet při bolesti v zádech, která neodpovídá aktivitě onemocnění, proto je vždy nutné provést rtg vyšetření páteře. Vertebrální fraktury také častěji způsobují neurologické komplikace než klasické vertebrální fraktury. Rizikovými faktory pro vznik vertebrálních fraktur jsou nízké BMD, mužské pohlaví, nižší BASFI, IBD.
Léčba by měla být komplexní, to znamená nefarmakologická a farmakologická. Z nefarmakologické léčby je důležité zdůraznit pravidelné cvičení. Důležité je nepoužívat systémové glukokortikoidy. Efektivní snížení aktivity AS pravděpodobně snižuje riziko vzniku fraktur. Pro léčbu mužské osteoporózy jsou indikovány risedronát, zoledronát, denosumab. Aplikace vápníku je samozřejmá.
Závěr
Co je tedy možné považovat za novinky v léčbě spondyloartritid v Česku? Jistě je pro praxi nejdůležitější novinkou vydání konsenzuálních Doporučení ČRS pro léčbu axSpA v loňském roce. Z těchto nových doporučení možno zdůraznit tyto body: diagnostika a klasifikace axSpA a doporučení pro obě formy axSpA, modifikace prahových kritérií pro biologickou léčbu, nová data o IL-17 inhibitorech a modifikace algoritmu výběru biologického léku. Nově jsou v doporučeních zařazeny kapitoly o léčbě pacientů s nejčastějšími komorbiditami axSpA.
prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav, Praha
