Axiální spondyloatritidy (axSpA) jsou chronická zánětlivá onemocnění, která typicky postihují axiální skelet (spondylitida), SI klouby (sakroileitida) a dále periferní klouby (artritidy) a další struktury – enteze (entezitida), daktylitida. Extraskeletální manifestace zahrnují akutní přední uveitidy, psoriázu a idiopatické střevní záněty. Společným znakem SpA je také nepřítomnost revmatoidních faktorů, různě silně vyjádřená přítomnost antigenu HLA-B27, familiární výskyt a vztah k infekci, který je jasný zejména u reaktivních artritid.
Novější klasifikační kritéria axiálních spondyloartritid pocházející od skupiny ASAS, umožňují časnou diagnostiku onemocnění. Kritéria jsou založena na přítomnosti chronické bolesti zad trvající déle než 3 měsíce u pacientů mladších 45 let. Kritéria mají větev zobrazovací, která počítá s detekcí sakroiliitidy pomocí magnetické rezonance (MR) nebo rentgenu (rtg.) sakroiliakálních skloubení (SIS), a dále větev klinickou, kdy musí mít pacient kromě antigenu HLA-B27 přítomny i minimálně další dva typické příznaky ze spondyloartritického spektra (obrázek 1).
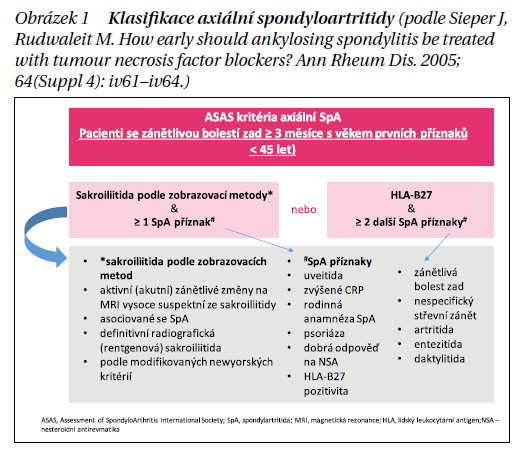
Formy axSpA
Rozlišuje se forma s již vyjádřenými rtg. změnami na SI skloubení (radiografická forma, ankylozující spondylitida) a tzv. non radiografická axSpA, kde je sakroiliitida definována přítomností aktivních zánětlivých lézí (kostního edému) na MR.
Závažnost onemocnění je dána aktivitou, úrovní bolesti a vlivem na kvalitu života. Dlouhodobě aktivní onemocnění je asociováno s progredujícím strukturálním postižením páteře s postupným omezením rozvoje jednotlivých segmentů páteře, tuhnutím a disabilitou. Prototypem axSpA je ankylozující spondylitida (AS), dříve známá pod pojmem Bechtěrevova nemoc. Onemocnění je 2–3× častější u mužů v porovnání se ženami a objevuje se převážně mezi 20. a 40. rokem věku. Postihuje 1,4 % populace celosvětově a je významnou příčinou nejen disability a morbidity, ale i zvýšené mortality. Tradiční biomarker aktivity onemocnění představuje CRP, který je i prediktorem strukturální progrese a odpovědi na léčbu. V rámci zobrazovacích metod lze nejlépe aktivitu onemocnění sledovat pomocí magnetické rezonance (MRI). Nález na MRI koreluje s hladinami CRP, které předurčují rozvoj sakroileitidy a osteoproduktivních změn – syndezmofytů.
Současná léčba axSpA
Konvenční léčbu lze rozdělit na nefarmakologickou, farmakologickou a chirurgickou. Cílem léčby u AS je snížit bolest, ztuhlost a únavnost, udržet či zlepšit funkci a pokusit se zpomalit strukturální progresi nemoci.
Podle recentních Doporučení ČRS pro léčbu axSpA má být terapeutická strategie navržena individuálně podle přítomných symptomů onemocnění.
Léčba by měla být směřována k cíli (koncept „treat to target“), tímto cílem má být remise či stav nízké aktivity, přičemž jako vhodný nástroj ke zhodnocení aktivity se jeví skóre ASDAS.
Základem léčby každého pacienta je celoživotní cvičení, které pomáhá udržovat pohyblivost páteře, rehabilitace a lázeňská péče.
Nesteroidní antirevmatika
Z farmakologické léčby jsou první volbou nesteroidní antirevmatika (NSA). NSA tlumí zánět i bolest, přičemž dobrá odpověď na NSA je u pacientů se zánětlivou bolestí zad v rámci symptomatologie axSpA udávána až u 70 % pacientů.
Konvenční chorobu modifikující léky
Účinnost konvenčních chorobu modifikujících léků (csDMARDs) u čistě axiálních forem axSpA nebyla prokázána. U periferních forem onemocnění je běžně používán sulfasalazin, jehož efektivita u periferních projevů spondyloartritidy byla prokázána v několika klinických hodnoceních. Maximální dávka je 3 g/den. Použití MTX v léčbě axSpA není vhodné, klinických hodnocení v této indikaci je málo a většinou s negativními výsledky. Systémové glukokortikoidy u AS indikovány nejsou.
Biologická léčba
Pokud je terapie dvěma NSA v plných dávkách, podávaných po dobu 4 týdnů bez efektu a přetrvává‑li klinická aktivita onemocnění, je indikováno zahájení biologické léčby. Z biologických léků jsou využívány inhibitory TNFα a blokátory IL‑17. K dispozici je celá řada důkazů o účinnosti anti-TNF léčby v terapii radiografických a kromě infliximabu i non radiografických forem axSpA. Léčba TNF inhibitorem vede k poklesu reaktantů akutní fáze, ústupem zánětlivých změn na MRI páteře a SI kloubů. TNFi ovlivňují všechny projevy SpA, jak axiální, tak i periferní (artritida, entezitidy, daktylitida) a řadu extraskeletálních manifestací (uveitidy, IBD).
V ČR jsou registrovány dva inhibitory Il-17: sekukinumab a ixekizumab. Oba jsou prokazatelně velmi účinné v léčbě non radiografické i radiografické axSpA (ankylozující spondylitidy) s rychlým nástupem účinku a redukcí axiálních a periferních projevů SpA, dlouhodobým efektem, redukcí zánětu na MRI a zpomalením rtg. progrese. Nelze je podávat pacientům s přítomným IBD, není evidentní jejich vliv na uveitidy.
Inhibitory Janusových kináz (JAK inhibitory, jakiniby)
Představují zcela novou třídu chorobu modifikujících léčiv (DMARDs). Nejedná se o biologické léky, ale o malé molekuly vznikající chemickou syntézou. Patří do skupiny cílených syntetických DMARDS (ts DMARDs). JAK jsou cytosolové enzymy z rodiny tyrosinkináz, které zodpovídají za zprostředkování nitrobuněčné signalizace. Popsány jsou 4 Janusovy kinázy: JAK-1, JAK-2, JAK-*3 a tyrosinkináza 2 (TYK-2). Signál z cytokinového receptoru aktivuje JAK kinázy, následnou aktivaci transkripčního faktoru STAT (signal transducer and activator of transcription), který se jako dimer přesune do jádra, váže se na promotorovou oblast a spouští transkripci genů regulujících imunitní odpověď. V současné době je pro klinické využití pro léčbu imunologicky podmíněných zánětlivých onemocnění schváleno v rámci Evropské unie 5 JAK inhibitorů, a to tofacitinib, baricitinib, upadacitinib, filgotinib a abrocitinib. Pro léčbu axSpA mají platnou indikaci tofacitinib a upadacitinib. Tofacitinib je potentní, selektivní inhibitor rodiny JAK. V enzymatických analýzách tofacitinib inhibuje JAK-1, JAK-2, JAK-3 a v menším rozsahu TyK2. Tofacitinib (XELJANZ) byl nejprve schválen pro léčbu revmatoidní artritidy v r. 2012 v USA (v Evropě v r. 2017), v roce 2018 pro léčbu psoriatické artritidy a ulcerózní kolitidy a na podzim 2021 pro léčbu AS a juvenilní idiopatické artritidy (tabulka 1).
Etiopatogeneze axSpA a role JAK inhibice
V patogenezi SpA hrají významnou roli genetické faktory (silná asociace mezi AS a molekulou HLA-B27 a další geny), epigenetické modifikace s faktory, které je ovlivňují (věk, pohlaví, kouření, střevní mikrobiom) a buňky a aktivace imunitní odpovědi. Jednotlivé syndromy celého spektra SpA vykazují rysy autoimunitního i autoinflamatorního onemocnění se zapojením nespecifického a adaptivního imunitního systému.
Před téměř 30 lety byla popsána zvýšená exprese TNF (tumor necrosis factor) v bioptických vzorcích sakroiliakálních kloubů. Podstatně později bylo zjištěno, že kromě TNF je v patogenezi SpA klíčová role osy IL-23/IL-17. Interleukin (IL)17 je přirozeně se vyskytující cytokin, který se účastní normální imunitní odpovědi, alehraje i klíčovou roli v patogenezi SpA.
IL-17A je produkován celou řadou buněk imunitního systému, včetně Th-17 pozitivních lymfocytů, ovlivňuje funkci dalších buněčných populací (neutrofily, keratinocyty, endoteliální buňky, chondrocyty a osteoblasty) a vede k další aktivaci produkce zánětlivých cytokinů a chemokinů, které vedou kromě akcelerace zánětlivé odpovědi i k buněčné proliferaci, destrukci intracelulární matrix, vzniku kostních erozí a poškození chrupavky
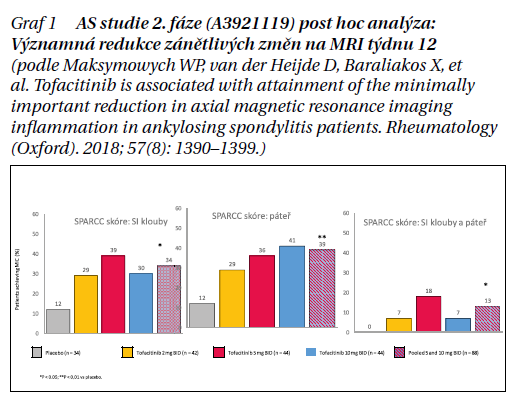
tolerovatelným bezpečnostním profilem. Několik cytokinů, včetně těch, které se podílejí na ose IL-23/IL-17, komunikuje prostřednictvím rodiny tyrosinkináz Janusovy kinázy (JAK). V důsledku toho může být dráha JAK terapeutickým cílem v léčbě axSpA. Tofacitinib, perorální inhibitor JAK, selektivně inhibuje JAK1, JAK2 a JAK3, přičemž preferuje JAK1 a JAK3 před JAK2. Efekt terapie tofacitinibem v indikaci axSpA byl potvrzen nejprve ve 12týdenním klinickém hodnocení fáze II. Přibližně u jedné třetiny pacientů s AS léčených tofacitinibem došlo ke klinicky významnému snížení (MIC) zánětu páteře na MRI v týdnu 12. Pacienti, kteří dosáhli MIC pro zánět na MRI, vykazovali i významnější klinickou odpověď (graf 1).
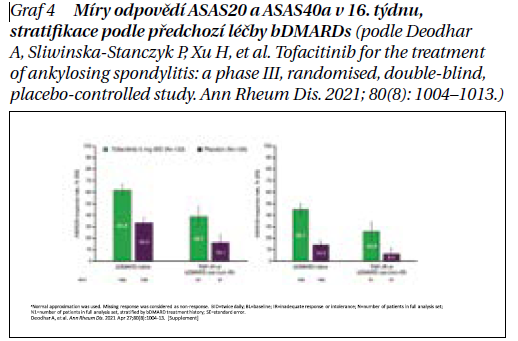
Schválení přípravku Xeljanz pro AS je založeno na údajích z fáze 3, multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studie, která hodnotila účinnost a bezpečnost tofacitinibu 5 mg 2× denně oproti placebu u 269 dospělých pacientů s aktivní AS. Výsledky studie jsou shrnuty v grafu 2.

Tato studie byla provedena mezi červnem 2018 a srpnem 2018 v 75 centrech v 14 zemích u pacientů s aktivní AS, kteří splnili Newyorská kritéria (rtg. SI kloubů byly centrálně hodnoceny) a selháním léčby dvěma NSA. Pacienti byli během dvojitě zaslepené fáze v prvních 16 týdnech randomizovaně rozděleni v poměru 1 : 1 k podávání tofacitinibu (5 mg 2× denně) nebo placeba. V otevřené fázi studie v týdnech 16–48 byli již všichni pacienti aktivně léčeni tofacitinibem 5 mg ve dvou denních dávkách.
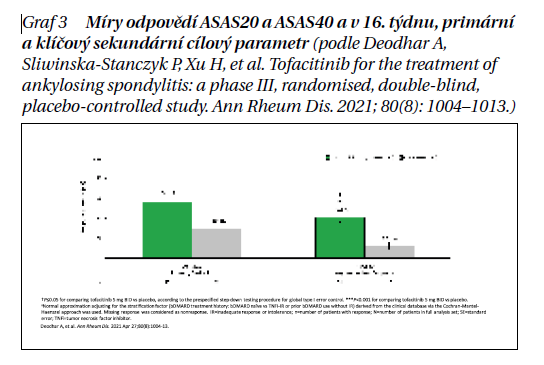
Primárním cílem studie bylo alespoň 20% zlepšení v odpovědi ASAS20 (Assessment in SpondyloArthritis International Society) v týdnu 16. Sekundárním cílem byla odpověď ASAS40 (≥ 40% zlepšení). Byla analyzována data celkem 69 pacientů (133 v aktivně léčené skupině a 136 v placebové skupině).
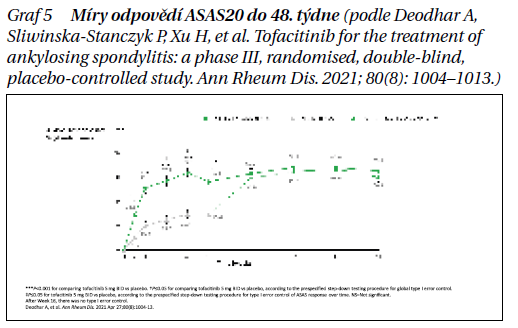
Studie splnila svůj primární cíl, že v 16. týdnu bylo procento pacientů, kteří dosáhli odpovědi ASAS20, významně vyšší u tofacitinibu (56,4 %, n = 75) oproti placebu (29,4 %, n = 40; p < 0,0001). Kromě toho procento pacientů, kteří dosáhli odpovědi ASAS40, bylo významně vyšší u tofacitinibu (40,6 %, n = 54) oproti placebu (12,5 %, n = 17; p < 0,0001), zásadního sekundárního cíle studie. Účinnost tofacitinibu přetrvávala i během otevřené fáze studie, v placebové skupině se klinická odpověď zlepšila po přechodu do aktivně léčeného ramene (týden 16) do týdne 24.
Bezpečnostní profil pozorovaný u pacientů s AS léčených přípravkem Xeljanz byl v souladu s bezpečnostním profilem pozorovaným u pacientů s revmatoidní artritidou (RA) a psoriatickou artritidou (PsA) (grafy 3, 4, 5).
Zajímavá jsou data ze síťové metanalýzy, provedené za použití přímých a nepřímých dat z randomizovaných kontrolovaných studií (RCT). Byla analyzována data ze šesti RCT zahrnujících 937 pacientů. které zkoumaly účinnost a bezpečnost tofacitinibu 5 mg, upadacitinibu 15 mg, filgotinibu 200 mg a sekukinumabu 150 mg u pacientů s aktivní AS, nedostatečnou odpovědí nebo intolerancí na nesteroidních protizánětlivých léků. Míry odpovědi podle ASAS20 byly významně vyšší ve skupinách s inhibitory JAK a sekukinumabem než ve skupině s placebem. Léčba tofacitinibem 5 mg byla spojena s nejvyšší pravděpodobností dosažení míry odpovědi ASAS20, následoval filgotinib 200 mg, upadacitinibe 15 mg sekukinumab 150 mg a placebo. Léčba tofacitinibem 5 mg byla rovněž spojena s nejvyšší pravděpodobností dosažení míry odpovědi ASAS40 (následoval upadacitinib 15 mg, secukinumab 150 mg, filgotinib 200 mg a placebo). Tofacitinib představuje účinnou možnost léčby pacientů s AS příznivým bezpečnostním profilem a komfortem perorálního podávání.¬
MUDr. David Suchý, Ph.D.
Oddělení klinické farmakologie, FN Plzeň
¬ Comparative Efficacy and Safety of Janus Kinase Inhibitors and Secukinumab in Patients with Active Ankylosing Spondylitis: A Systematic Review and Meta-Analysis. Pharmacology. 2022;107(11-12):537-544. doi: 10.1159/000525627.
