Proprotein konvertáza subtilisin/kexin typu 9 (PCSK9) je důležitou bílkovinou v metabolizmu LDL cholesterolu. Má zásadní význam v procesu degradace LDL receptoru. Ačkoliv byl význam PCSK9 objeven relativně nedávno, dnes už představuje inhibice PCSK9 nezastupitelný terapeutický prostředek v léčbě zvýšených koncentrací LDL cholesterolu. Mezi účinné sloučeniny, které patří do skupiny inhibitorů PCSK9, řadíme alirokumab (Praluent) a evolokumab (Repatha). Dostupná data z klinických studií poukazují na to, že PCSK9 inhibitory představují novou cestu v léčbě dyslipidemií a s ní asociovaných kardiovaskulárních onemocnění nejen u pacientů v sekundární prevenci, ale také u pacientů s familiární hypercholesterolemií.
Kazuistika pacienta (průběh terapie 2015–2023)
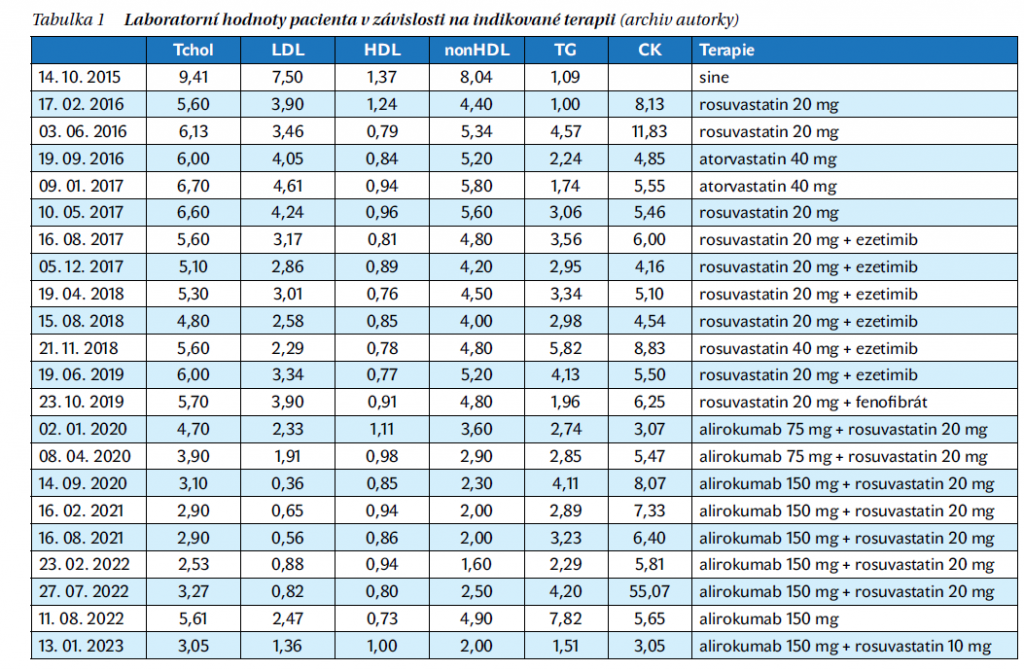
Pacient, ročník 1979, byl odeslán praktickým lékařem do naší lipidové poradny v roce 2015, kdy mu bylo 36 let, pro vysoký cholesterol (Tchol. 9,41 mmol/l, LDL chol. 7,50 mmol/l, TG 1,09 mmol/l).
O zvýšeném cholesterolu věděl již od dětství, ale nikdy se neléčil. Jinak byla jeho osobní anamnéza nevýznamná. V rodinné anamnéze pacienta byl vysoký cholesterol u jeho matky, která měla v 60 letech CMP. Pacientovi byla tedy podle Dutch score diagnostikována pravděpodobná familiární hypercholesterolemie (FH) – Dutch 6.
Pacientovi byl ihned nasazen rosuvastatin 20 mg, po kterém klesl jeho LDL cholesterol na 3,90, resp. 3,46 mmol/l. Pro zvýšení kreatinkinázy (CK) na 11,83 µkat/l byl v roce 2016 krátce vyměněn rosuvastatin za atorvastatin, ale po této výměně byly laboratorní výsledky horší, proto mu byl znovu nasazen rosuvastatin 20 mg a v roce 2017 přidán ezetimib 10 mg. Při této kombinaci byl pacientův LDL cholesterol v rozmezí cca 2,5–3 mmol/l. Podle tehdejšího doporučení měl mít pacient ve vysokém riziku, což jsou všichni pacienti s FH bez komplikací, LDL cholesterol < 2,6 mmol/l.
Začátkem roku 2016 bylo u pacienta provedeno genetické vyšetření FH a byla nalezena mutace v genu pro LDL receptor c.-140C>A v heterozygotní formě.
Po změně doporučení v roce 2019 byla přehodnocena cílová hodnota LDL cholesterolu u tohoto pacienta na < 1,8 mmol/l. Krátce byl navýšen rosuvastatin na 40 mg, což jsme dříve nezkoušeli z obav o zvýšení CK. Toto navýšení ale pacient netoleroval pro bolesti kloubů a také laboratorně došlo ke zvýšení CK na 8,83 µkat/l. V té době přestal pacient tolerovat i ezetimib pro gastrointestinální potíže. Z důvodu vyšší hladiny TG 4–5 mmol/l byla v terapii vyzkoušena i kombinace s fibráty (Rosucard 20 mg + Lipanthyl S215), ale při této kombinaci pociťoval svalové bolesti, proto byly fibráty z terapie vyjmuty.
V roce 2020 byla pacientovi na základě indikačních kritérií nabídnuta terapie inhibitory PCSK9, kterou akceptoval. Při kombinaci rosuvastatin 20 mg + alirokumab 75 mg klesl jeho LDL cholesterol na 2,33, resp. 1,91 mmol/l (o 40, resp. 51 %). Toto však nestačilo k dosažení cílové hodnoty, proto byl alirokumab navýšen na 150 mg. Při takto nastavené terapii byl pacient cca 2 roky kompenzován s hladinou LDL cholesterolu < 1 mmol/l.
V polovině roku 2022 přišel pacient na kontrolu s laboratorním nálezem, kde měl hodnotu CK 55,07 µkat/l. Popíral jakoukoliv fyzickou námahu, neudával svalové ani jiné potíže. Byl mu ihned vysazen rosuvastatin, ponechány jen injekce alirokumabu 150 mg a byl doporučen kontrolní odběr za 2 týdny. Při kontrolním odběru byla hladina CK již snížena na 5,65 µkat/l, naproti tomu hodnota LDL cholesterolu stoupla na 2,47 mmol/l. Proto byl opět nasazen rosuvastatin, ale ve snížené dávce 10 mg.
Poslední kontrola v lednu 2023 ukázala uspokojivé hodnoty jak LDL cholesterolu (1,36 mmol/l), tak i CK (3,05 µkat/l), pacienta tedy ponecháváme na terapii alirokumabem 150 mg + rosuvastatinem 10 mg.
Závěr
Na příkladu tohoto pacienta jsem se snažila ukázat, že nastavení léčby u pacientů s FH je dlouhodobý proces, který se nedá předem předvídat, a každá návštěva i dlouhodobě kompenzovaného pacienta může přinést nová překvapení. Díky léčbě inhibitory PCSK9 se nám daří dostat pod kontrolu cholesterol i u takových pacientů, u kterých bychom to jen za pomoci perorálních hypolipidemik nedokázali.
MUDr. Dana Bučková, Ph.D.
Ústav laboratorní medicíny – Oddělení klinické biochemie, FN Brno
