Respirační syncytiální virus (RSV) je důležitým původcem respiračních infekcí, řada z nich končí hospitalizací, případně úmrtím. Závažná jsou zejména onemocnění u dětí do 5 let a dále ve starší části populace. Vzhledem k tomu, že se v současnosti výrazně rozšiřují naše možnosti specifické prevence, je žádoucí shrnout aktuální poznatky o této infekci.
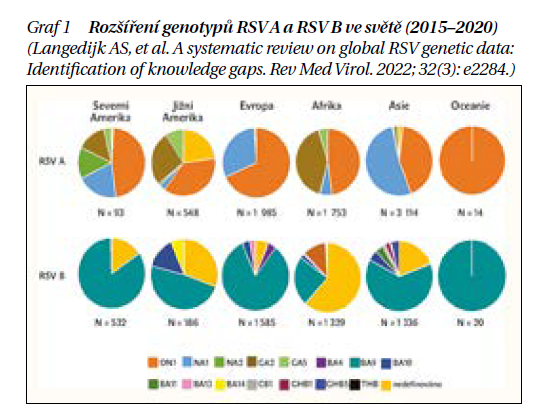
Respirační syncytiální virus (RSV) byl poprvé izolován v roce 1955 z nemocných šimpanzů v amerických armádních laboratořích. U lidí byl poprvé zachycen roku 1956 jako původce respiračních infekcí dětí. Jedná se o obalený jednovláknový RNA virus patřící do rodu Orthopneumovirus z čeledi Pneumoviridae. Nukleová kyselina obsahuje celkem 10 genů, které kódují 11 proteinů. V obalu viru jsou tři virové proteiny: fúzní protein F, glykoprotein G a hydrofobní protein SH. Význam proteinů F a G je zásadní z hlediska imunopatogeneze, a proto jsou důležité i při přípravě specifické prevence. Existuje pouze 1 sérotyp, který se rozlišuje na 2 subtypy RSV-A a RSV-B. Další klasifikace se vyvíjí a není celosvětově sjednocena (graf 1).
Přenos infekce
K přenosu dochází přímo kapénkami a nepřímo prostřednictvím kontaminovaných předmětů a rukou. V prostředí může virus dlouhodobě přežívat, např. na rukou 30 minut, na kapesnících až hodinu, na dětských textilních či plastových hračkách i několik hodin. Reprodukční index se pohybuje v rozmezí 1,7–8,2. Na základě vysoké infekciozity celosvětově promořuje cca 90 % dětí již do 2 let věku. Významnou roli v přenosu mají bezpříznakoví jedinci s touto infekcí. Virus se vylučuje 3–8 dnů. U lidí s imunosupresí může být toto období výrazně delší – až 4 týdny po klinické úzdravě. Vysoká infekciozita původce napomáhá i jeho šíření v nemocničním prostředí.
Inkubační doba
Inkubační doba se pohybuje mezi 2–8 dny, s průměrem 5 dnů. Je je ovlivněna věkem, přítomnými komorbiditami, ale i tím, zda jde o primární infekci; delší byla zaznamenána u malých dětí a imunosuprimovaných osob. K inokulaci dochází na nazofaryngeální a konjunktivální sliznici, odtud se virus dále šíří do dýchacího systému.
Klinický průběh onemocnění
RSV je významným původcem onemocnění horních a dolních cest dýchacích (HCD a DCD) ve všech věkových skupinách. Při akutní infekci dochází k výraznému zvýšení odporu dýchacích cest, snížení jejich průchodnosti zánětem a hlenem. Příznaky se pohybují od mírných (rýma, ucpání nosu, kašel) až po závažné projevy těžké infekce (tachypnea, prodloužené exspirium, hypoxie, letargie aj.), které mohou vést k hospitalizacím a úmrtím. Komplikované průběhy končí na jednotkách intenzivní péče, vyžadují mechanickou ventilaci. Může dojít ke kardiopulmonálním komplikacím a chronické obstrukční pulmonální nemoci.
Závažnost klinických projevů je ovlivněna především věkem – těžkými průběhy infekce jsou nejvíce ohroženy nedonošené děti a nejmladší děti (zejména do 6 měsíců), lidé ve věku 65 let a starší, dále všichni bez ohledu na věk při přítomnosti dalších chronických onemocnění. RSV se podílejí na etiologii dětských bronchiolitid až v 60–80 %, 40 % na pneumoniích.
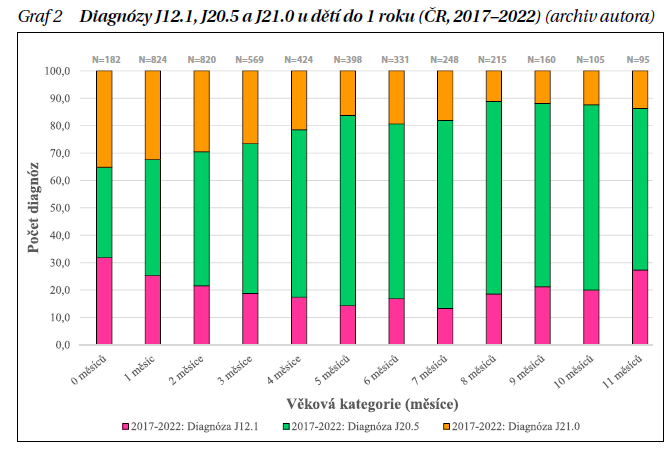
Onemocnění trvá 7–21 dnů, doba hospitalizace se pohybuje mezi 4–7 dny. Častější výskyt je udáván u mužů, resp. chlapců. Imunita po prodělané infekci je krátkodobá, během života dochází k opakovaným reinfekcím. I když u většiny onemocnění dochází k plné úzdravě, u malých dětí je po primoinfekci popisováno vyšší riziko astmatu a chronického sípání (pískání); diskutuje se i riziko alergické senzibilizace. Průběh infekce může být ovlivněn i koinfekcí, některé z nich ale základní průběh onemocnění paradoxně zmírňují (graf 2).
Diagnostické přístupy
Infekce RSV je primárně diagnostikována klinicky na základě příznaků a znalosti o cirkulaci agens v populaci. Vzhledem ke krátkému průběhu onemocnění je třeba provádět vyšetření s rychlým výsledkem. Při hospitalizaci, zejména na jednotkách intenzivní péče má znalost etiologie význam i z hlediska antibiotické preskripce. Vzhledem k tomu, že řadu klinických forem této infekce nelze klinicky odlišit od ostatních respiračních virových infekcí, je nutná jejich laboratorní diagnostika přímými či nepřímými metodami. V současnosti se používají především přímé metody, tj. průkaz antigenu a nukleové kyseliny (např. PCR). Nevýhodou průkazu antigenu je nižší citlivost postupu, metoda PCR je zase významně dražší (současně má ale velmi vysokou senzitivitu i specificitu), s výhodou se dnes proto používá formou multiplexové detekce pro určení více virů najednou.
Podmínkou kvalitní diagnostiky je ale vždy správný odběr vzorků z dýchacích cest – současně by měl být prováděn výtěr z dutiny nosní i ze zadní stěny faryngu. Další možností je vyšetření aspirátu z dolních dýchacích cest či bronchoalveolární laváže. Kultivační průkaz je možný, ale je časově náročný; detekce protilátek má dnes význam spíše epidemiologický.
Doplněním diagnostiky jsou i různé zobrazovací metody, vzhledem k nespecificitě vyšetření jsou ale především pomocným vyšetřením.
Sezónnost onemocnění
Výskyt infekcí vyvolaných RSV má typický sezónní charakter. Epidemie začínají na jižní polokouli, následně se v září–prosinci vyskytují na severní polokouli. V evropských zemích dochází k nárůstu onemocnění v zimním období v závislosti na teplotách a relativní vlhkosti. Sezónní výskyt infekcí RSV trvá cca 8–18 týdnů, výskyt ve východní části kontinentu je posunut cca o 4 týdny za západní Evropou; 76 % hospitalizací s touto infekcí proběhne během listopadu–března. Pravidelnost sezónního výskytu byla celosvětově významně ovlivněna nespecifickými opatřeními během pandemie COVID-19.
Riziko hospitalizace
Na základě analýzy publikovaných studií bylo odhadnuto, že v roce 2019 ve světě proběhlo u dětí do 5 let 33 milionů akutních onemocnění DCD vyvolaných RSV, z nich 101 400 skončilo úmrtím. Z 3,6 milionu onemocnění, která si vyžádala hospitalizaci, zemřelo během ní 26 300 dětí. Celosvětově se odhaduje, že na základě akutních infekcí dolních dýchacích cest vyvolaných RSV dochází cca u 9,7, resp. 10,9 % dětí k hospitalizaci s významnými rozdíly mezi vyspělými a rozvojovými zeměmi.
Důležitým zdrojem informací je odhad počtu hospitalizací v Evropské unii u dětí do 5 let. Podle tohoto systematického odhadu zpracovaného před pandemií COVID-19 je ročně s infekcí RSV hospitalizováno v průměru 245 244 dětí do 5 let (10 060/100 000), v ČR 5 666. Na základě tohoto odhadu bylo propočteno, že riziko hospitalizací v naší republice je ve věkové skupině 0–2 měsíce 7 390/100 000, ve věkové skupině 3–5 měsíců 4 100/1000 000, nejnižší ve věku 36–59 měsíců, tj. 110/100 000. Na základě analýzy počtu hospitalizací v ČR v letech 2017–2022 lze odhadovat riziko hospitalizace na 100 000 a rok pro děti do 6 měsíců na 891,59, pro děti do 1 roku 586,36, pro děti mladší než 5 let 156,09. Odhadované riziko je několikanásobně nižší než uváděné v literatuře (tabulka 1).
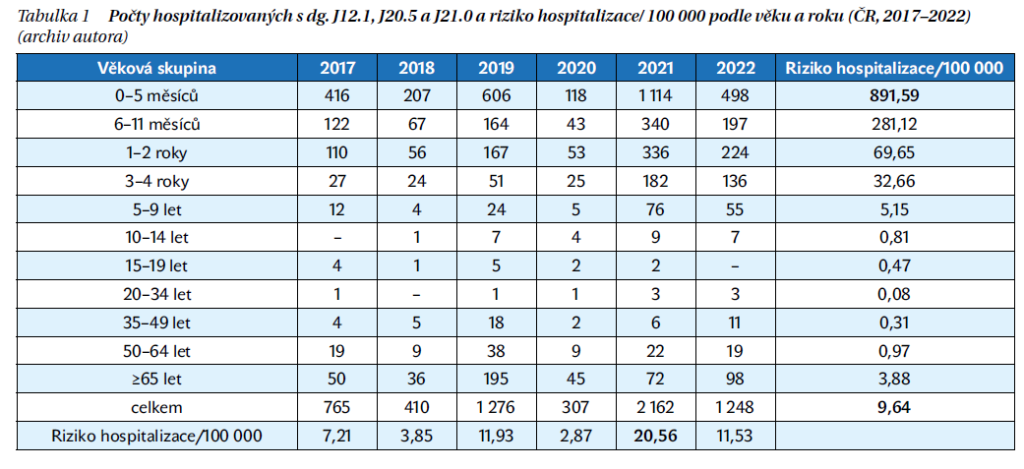
Za významný rizikový faktor pro hospitalizaci v prvních letech života se považuje zejména nedonošenost a komorbidity. Řada studií ale potvrzuje, že většina hospitalizovaných dětí do 2 let byla do té doby považována za zdravé. Z toho vyplývá, že současná specifická preventivní opatření pro většinovou zdravou část dětské populace jsou nedostatečná.
Infekce RSV jsou četné a klinicky významné i u dospělých. I zde platí, že kromě rozdílu mezi jednotlivými zeměmi, dochází i k rozdílům ve výskytu této infekce a její závažnosti ve vyspělých a rozvojových zemích. V současnosti se odhaduje, že v USA ročně dochází u 65letých a starších osob k 177 000 hospitalizací. Retrospektivní data z 6 evropských zemí a jejich analýza potvrdily pokles rizika hospitalizace u starších dětí a mladších dospělých, u osob ve věku 65–74 let bylo v jednotlivých zemích riziko vypočítáno na 600–1 600/100 000, u 85letých a starších na 100–6 000/100 000. Na základě této a dalších analýz bylo odhadnuto riziko hospitalizace s infekcí RSV v Evropské Unii a Norsku. Nejvyšší riziko bylo propočteno pro věkovou skupinu 85letých a starších (2 990/100 000). Pro ČR bylo odhadnuto riziko hospitalizace u 65letých a starších na 2 890/100 000. Každoročně dochází u 18letých a starších k 158 229 hospitalizacím; pro ČR byl odhadnut počet hospitalizací na 2 819, 2 514, tj. 89,2 % z nich, by mělo být ve věku nad 65 let. Na základě analýzy za období 2000–2021 bylo odhadnuto, že ve vysokopříjmových zemích došlo v roce 2019 u 60letých a starších osob k 5,2 milionu akutních respiračních onemocnění vyvolaných RSV, 470 000 hospitalizacím a 33 000 úmrtím během hospitalizace. Odhady pro rok 2025 jsou ještě vyšší.
Značný rozptyl výsledků jednotlivých studií a z toho vyplývajících odhadů je významně ovlivněn mj. geografickými rozdíly, dobou sledování, metodami surveillance a definicemi případů.Riziko úmrtíSmrtnost u hospitalizovaných dětí se udává v rozmezí 0–33 % s výraznými rozdíly podle přítomnosti rizikových faktorů, jako jsou chronické plicní onemocnění, kongenitální srdeční vada, nedonošenost. Při analýze úmrtí u hospitalizovaných ve vyspělých zemích byla propočtena nejnižší úmrtnost ve věkové skupině 5–17 a 18–49 let, nejvyšší úmrtnost ve věkové skupině 65letých a starších – 29,6–622,0/100 000 a u dětí do 1 roku 7,2–66,0/100 000. Podle starších celosvětových dat jsou dopady infekce RSV významně rozdílné i na základě hospodářské vyspělosti – odhadovaná smrtnost v důsledku těžkého onemocnění DCD souvisejícího s infekcí RSV u dětí do 5 let v průmyslových zemích se pohybuje kolem 0,3 %, v rozvojových zemích 2,1 %. V letech 1999–2018 v USA ročně v souvislosti s infekcí RSV umíralo 96 dětí do 1 roku – úmrtnost na tuto infekci byla v této věkové skupině 5× vyšší než na chřipku. Nejvyšší úmrtnost byla zjištěna ve věkové skupině 65letých a starších (46,8/100 000) – ročně zde umírá cca 14 000 lidí starších než 65 let.
Léčba
Léčba je převážně symptomatická a podpůrná. Jejím základem je především dostatečný přívod tekutin, oxygenace, snižování horečky, případně aplikace antibiotik pro prevenci superinfekce. Při respiračním selhání je indikována řízená ventilace.
Specifická terapie bohužel neexistuje, léčba ribavirinem je účinná jen pro vysoce rizikové skupiny dětí, existují zahraniční doporučení pro aplikaci u hematoonkologických pacientů. Zkoušejí se i léky, které se osvědčily při terapii infekcí vyvolaných koronaviry.
Nespecifická prevence
Vzhledem k dlouhodobému vylučování původce po infekci a jeho přežívání v prostředí je žádoucí důsledné mytí rukou nejen v domácnostech nemocných, ale zejména v nemocničním prostředí. Důležitá je i dekontaminace prostředí. Za významný způsob prevence se považuje i kojení – ovlivňuje nejen závažnost některých projevů, ale i dobu hospitalizace i způsobu léčby. Nejrůznější nefarmaceutická preventivní opatření proti infekci COVID-19 (lock-down, izolace, omezení pohybu, nošení ústenek a respirátorů, přerušení předškolní a školní výuky, resp. výchovy) ovlivnila příznivě výskyt řady infekcí včetně infekcí vyvolaných RSV.
Specifická prevence
Přestože jsou infekce RSV považovány za celosvětovou zdravotnickou prioritu, byla dosud jedinou možností specifické prevence pasivní imunizace monoklonálními protilátkami, tj. palivizumabem (přípravek Synagis). Indikace jeho podání je vzhledem k vysoké ceně poměrně zúžená, takže je podáván v jednotlivých zemích cca 2 % nově narozených dětí. Omezeně je z tohoto důvodu dostupný v rozvojových zemích. V minulosti byl jednoznačně potvrzen příznivý dopad na riziko hospitalizací, riziko pobytu na jednotkách intenzivní péče a oxygenoterapie dětí s touto profylaxí – rozšiřování jeho indikací je proto velmi žádoucí. Nevýhodou je nutnost opakovaného podávání 1× měsíčně v období nejvyššího rizika infekce RSV. Indikace v různých zemích jsou rozdílné a průběžně se mění. Poslední rozhodnutí o používání a proplácení tohoto preparátu zdravotními pojišťovnami v ČR bylo schváleno Státním ústavem pro kontrolu léčiv v roce 2016, indikace byly vytvořeny na základě kombinací gestačního věku, porodní hmotnosti, určených závažných diagnóz a rizikových kontaktů, t. č. jde o 6 indikačních skupin.
Je proto žádoucí, aby co nejdříve byla v ČR stanovena úhrada podle nových rozšířených indikací s využitím rizikových parametrů, které doporučila v r. 2023 Česká neonatologická společnost a Společnost dětské pneumologie ČLS JEP. Dříve nebo později se i na našem trhu objeví další monoklonální protilátky s delším profylaktickým účinkem (na bázi nirsevimabu, clesrovimabu aj.).
Důležitou součástí preventivních opatření bude v blízké budoucnosti nepochybně i očkování, tj. aktivní imunizace. Vzhledem k tomu, že první snahy o zavedení očkovacích látek skončily v 60. letech minulého století neúspěšně, byla tato strategie na několik desítek let opuštěna. Na základě vývoje molekulární virologie byla přečtena struktura důležitého proteinu F a v současnosti probíhají nejrůznější klinické studie, které jsou v různých fázích. Připravují se vakcíny na bázi proteinů (tvořené partikulemi, subjednotkové), živé (na bázi vektorů, atenuované), chimérické, mRNA vakcíny. Jejich využití bude odlišné i pro jednotlivé věkové skupiny. Samostatně se vyvíjejí vakcíny určené pro děti mezi 6 měsíci až 4 roky, pro starší děti, pro těhotné ženy, pro populaci nad 60 let.
Na podzim roku 2023 začaly být v ČR distribuovány 2 očkovací látky. Vakcína firmy GSK AREXVY je určena pro aktivní imunizaci za účelem prevence onemocnění DCD způsobeného RSV u dospělých ve věku 60 let a starších, očkovací látka firmy Pfizer ABRYSVO je indikována pro pasivní ochranu před onemocněním dolních cest dýchacích způsobeným RSV u kojenců od narození do 6 měsíců věku po imunizaci matky během těhotenství a k prevenci onemocnění DCD způsobeného RSV aktivní imunizací osob ve věku 60 let a starších. Obě se aplikují v jedné dávce. Doba účinnosti je zatím stanovena na 1 rok, lze ale předpokládat, že po ukončení příslušných studií bude delší. Cena je předběžně kalkulována cca na 5 000 Kč. Některé zdravotní pojišťovny uvažují o částečné úhradě vakcín.
Závěr
Současný rychlý rozvoj specifické prevence infekcí vyvolaných RSV vyžaduje sjednocení metod surveillance, které by na jedné straně umožnily porovnání mezi jednotlivými státy, ale hlavně pomohly při odhadech zdravotnické a ekonomické zátěže těchto infekcí v jednotlivých zemích. Důležité je získat co nejkvalitnější data ještě před zahájením plošných specifických opatření, aby mohla být časem hodnocena i jejich efektivita. Do budoucnosti není ale pasivní surveillance vycházející z dostupných registrů hospitalizace dostatečná; musí být doplněna aktivní komunitní a nemocniční surveillance. A do ní se může zapojit většina čtenářů tohoto článku!
prof. MUDr. Petr Pazdiora, CSc.
Lékařská fakulta v Plzni, UK
