Cílená terapie malými molekulami, která inhibuje proteiny Janusovy kinázy (JAK), je účinná možnost léčby autoimunitních a revmatických onemocnění, zejména u revmatoidní artritidy, spondyloartritidy, psoriázy, atopické dermatitidy či zánětlivých střevních onemocnění. Využití jednotlivých JAK závisí na jejich selektivních interakcích s konkrétními cytokinovými receptory.
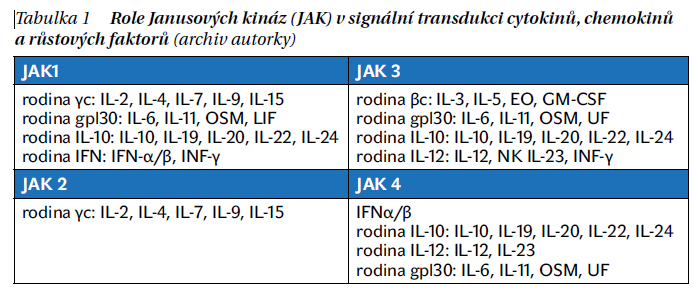
JAK proteinkinázy/tyrosinkinázy jsou důležitými regulátory buněčných funkcí, které tvoří rozmanitou rodinu s 518 geny identifikovanými v rámci projektu lidského genomu. Základním mechanismem je vazba řady cytokinů a růstových faktorů na receptory proteinkináz, což vede k fosforylaci JAK asociovaných s receptorem. Fosforylace aktivuje JAK, a ty následně fosforylují intracelulární složky receptorů, což umožňuje nábor transkripčních faktorů rodiny přenašečů signálu a aktivátorů transkripce (STAT). Aktivované proteiny STAT se přemisťují do jádra a indukují transkripci, přičemž intracelulární transdukce signálu zahrnuje kombinace čtyř izoforem JAK (tabulka 1) a tyrosinkinázy 2 (TYK2) a sedmi členů rodiny STAT.
Selektivita každého inhibitoru JAK určuje jeho účinek na konkrétní zánětlivé reakce
Inhibitory JAK selektivně zasahují do vazebného místa pro adenosin trifosfát, což vede k potlačení navazujících signálních drah, které mohou mít imunomodulační účinky v celé řadě patologických procesů mechanismem inhibice signální dráhy mnoha cytokinů zprostředkované STAT. Léčba založená na mechanismu zaměřeném na několik cytokinů a jejich signalizaci tak přinesla změnu paradigmatu ve strategii léčby refrakterních systémových autoimunitních onemocnění.
Úspěch inhibitorů JAK usnadnil výzkum nitrobuněčné signální transdukce v imunitních buňkách a jejího významu pro patologické procesy, jakož i vývoj inhibitorů cílů včetně slezinné tyrosinkinázy, Brutonovy tyrosinkinázy a kinázy 4 asociované s receptorem IL-1, které jsou předmětem klinických zkoušek. Je pozoruhodné, že některé inhibitory JAK mají aktivitu také proti tyrosinkinázám rodiny Tec (ritlecitinib) a slezinné tyrosinkináze, která hraje důležitou roli při ničení krevních destiček (gusacitinib).
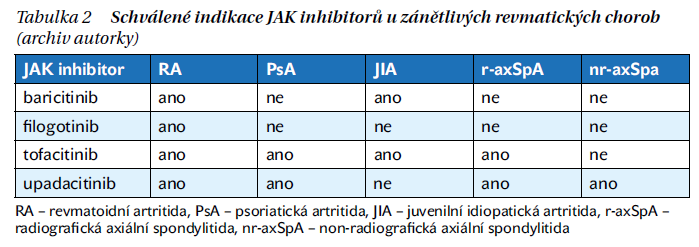
Pět inhibitorů JAK (tofacitinib, baricitinib, peficitinib, upadacitinib a filgotinib) je v současné době schváleno různými agenturami pro léčbu RA a jsou zařazeny do kategorie tsDMARDs (tabulka 2).
Kromě artritidy a zánětlivých střevních onemocnění se inhibitory JAK studují i u dalších autoimunitních, zánětlivých a alergických onemocnění, včetně neinfekční uveitidy, obrovskobuněčné arteritidy, systémové sklerózy, Sjögrenova syndromu či dermatomyozitidy.
Původně nepředpokládanou úlohou inhibitorů JAK je jejich použití v léčbě COVID-19 pro oslabení dysregulované produkce a působení prozánětlivých cytokinů včetně IL-2, IL-6, IL-12, IFNγ a GM-CSF v rámci cytokinové bouře spojené s COVID-19, kdy extrémní zvýšení koncentrací cytokinů je spojeno s plicním a endoteliálním onemocněním, poškozením myokardu a mortalitou.
Baricitinib se od ostatních inhibitorů JAK liší tím, že inhibuje také AP2 asociovanou proteinkinázu 1, klíčový regulátor endocytózy závislé na klatrinu, a mohl by tak inhibovat vstup viru do cílových buněk. V klinických studiích byla kombinace baricitinibu a remdesiviru účinnější než monoterapie remdesivirem jak z hlediska zlepšení oxygenace, tak z hlediska snížení vybraných zánětlivých markerů u pacientů s pneumonií COVID-19, kteří dostávali doplňkový kyslík, vysokoprůtokový kyslík nebo neinvazivní ventilaci. Klinické studie zahrnující několik inhibitorů JAK v léčbě COVID-19 probíhají a měly by poskytnout cenné informace o užitečnosti těchto látek. Kromě současných indikací vyvstává otázka, zda by inhibitory JAK mohly hrát roli v léčbě sepse a syndromu akutní respirační tísně.
Cílené terapie
Hlavní prioritou výzkumu v oblasti JAK inhibitorů by však mělo být možné zlepšení terapeutických strategií, včetně strategií pro udržení vyváženého profilu účinnosti a bezpečnosti, jakož i důkladné provádění screeningu při zahájení léčby a monitorování během léčby. Kromě toho by cílené terapie založené na mechanismu, jako jsou inhibitory JAK, mohly v konečném důsledku umožnit buď výrazné snížení až vysazení glukokortikoidů, nebo zamezení jejich užívání u některých autoimunitních onemocnění. U mnoha z těchto stavů je intenzivní a vhodná indukční terapie předpokladem pro dosažení remise onemocnění a pro udržení remise bez poškození orgánů včetně kloubů a páteře.
Mohly by však existovat faktory, které brání přechodu od remise k vyléčení, a to nejen v imunitním systému, ale také v mezenchymálním, střevním, nervovém a metabolickém systému. Ačkoli následné účinky inhibice JAK in vivo nejsou zcela objasněny, je známo, že JAK dependentní cytokinová signalizace je ovlivněna individuální variabilitou faktorů, jako jsou jednonukleotidové polymorfismy (SNP) ovlivňující izoformy STAT, průnik a distribuce léčiv do tkání, expresní vzorce JAK v místech zánětu a dynamická rovnováha T folikulárních pomocných buněk, T periferních pomocných buněk, TH17 buněk i regulačních T buněk. Inhibitory JAK cílí na více cytokinů, růstových faktorů a endokrinních faktorů, takže by mohly mít potenciál regulovat jakýkoli aktivní faktor inhibující přechod k vyléčení. Objasnění takových faktorů a přístupů k jejich regulaci by mohlo být důležitou strategií při řešení problémů a neuspokojených potřeb v léčbě autoimunitních onemocnění.
JAK inhibitory v klinické praxi
JAK inhibitory jsou narůstající skupinou cílených syntetických chorobu modifikujících léků (tsDMARD). V současnosti jsou v České republice (ČR) k dispozici čtyři JAK inhibitory (tofacitinib, baricitinib, upadacitinib, filgotinib) pro léčbu revmatoidní artritidy (RA). Část z nich je registrovaná i v dalších revmatologických indikacích, mezi které patří psoriatická artritida a axiální spondyloartritidy (tabulka 2). Pátý JAK inhibitor pro léčbu RA, peficitinib, zatím není ČR k dispozici. Klinické studie a data z národních a nadnárodních registrů prokázaly u JAK inhibitorů (mono terapii, nebo v kombinaci s methotrexátem (MTX) noninferioritu vůči biologické léčbě (bDMARD).
Výhodou JAK inhibitorů je jejich tabletová forma, poměrně rychlý nástup účinku a efektivita v monoterapii. Revmatologie není jediný obor, ve kterém JAK inhibitory našly uplatnění, dále např. v gastroenterologii, hematologii dermatologii a dalších. V současnosti probíhá celá řada klinických studií v dalších potenciálních indikacích.
Selektivita k jednotlivým JAK definuje vlastnosti JAK inhibitoru jak účinnost, tak potenciální nežádoucí účinky. Dimerizace JAK1 s JAK2 umožňuje signalizaci IL-6 a interferonu γ (IFNγ), JAK1 s TYK2 vede k přenosu signálu IFNα/β. JAK2 homodimer je odpovědný́ za signalizaci hematopoetických růstových faktorů, zejména erytropoetinu a trombopoetinu nebo faktoru stimulujícího granulocytární a makrofágové kolonie (GM-CSF).
Baricitinib
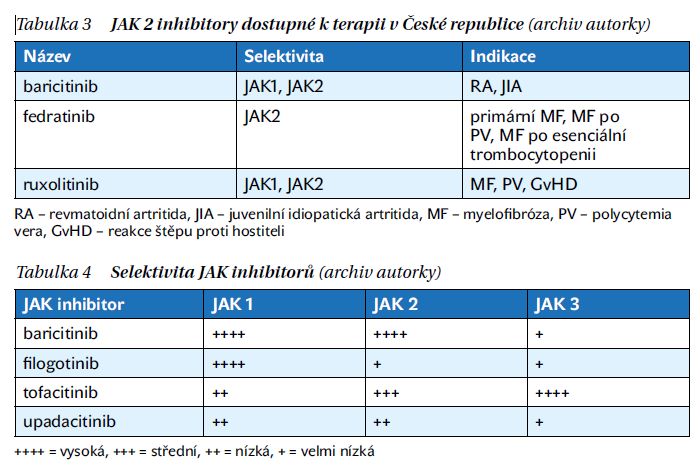
Baricitinib je selektivní inhibitor JAK1/JAK2 s unikátními farmakologickými vlastnostmi ovlivňujícím inhibici klíčových prozánětlivých cytokinů v patogenezi zánětlivých autoimunitních revmatologických onemocnění (tabulky 3 a 4). Baricitinib byl schválen v monoterapii nebo v kombinaci s MTX k léčbě dospělých se středně těžkou až těžkou RA.
Farmakologické vlastnosti, způsob podávání a nežádoucí účinky
Baricitinib je, jak už bylo zmíněno výše, selektivní́ inhibitor JAK1 a 2. Hodnoty poloviční maximální inhibiční koncentrace (IC50) pro JAK-1 byly 5,9 nM, JAK-2 5,7nM a JAK-3560 nM. Baricitinib selektivně inhibuje JAK a nevykazuje signifikantní inhibiční vlastnosti k ostatním kinázám. In vitro baricitinib inhiboval IL-6 zprostředkovanou fosforylaci STAT3 a následnou produkci MCP-1 (monocyte chemoattractant protein-1). Byla prokázaná inhibice IL-17 a IL-22 v T lymfocytech. Maximální inhibice po dodání baricitinibu bylo dosaženo po 2 hodinách a po 24 hodinách dochází k poklesu efektu a na výchozí stav.
Biodostupnost baricitinibu je odhadována na 79 %. Eliminace baricitinibu je převážně ledvinami a poločas eliminace byl u pacientů s RA 9,42 l/h. Renální insuficience výrazně ovlivňuje tento poločas baricitinibu. Tělesná hmotnost, věk, pohlaví a rasa neměly vliv na farmakokinetické a farmakodynamické vlastnosti baricitinibu.
Baricitinib je v České republice registrován pro nemocné s RA, juvenilní idiopatickou artritidou (JIA), atopickou dermatitidou, alopecii areatou a předpokládá se, že bude registrován i v dalších indikacích.
Baricitinib je podáván 1× denně v dávce 4 mg u pacientů s RA. Redukovaná dávka 2 mg denně je doporučována pro pacienty s vyšším rizikem tromboembolických příhod, závažných nežádoucích kardiovaskulárních příhod, malignit, pro pacienty s chronickými či recidivujícími infekcemi v anamnéze a pro pacienty nad 65 let věku. Snížení dávky ze 4 mg na 2 mg může být zváženo u pacientů, kteří dosáhli remise. U JIA je doporučována dávka 4 mg denně pro pacienty s hmotností nad 30 kg a vyšší, u pacientů s hmotností nižší než 30 kg jsou doporučovány 2 mg denně. Není určena denní doba podávaní léku. Léčba baricitinibem nesmí byt zahájena u pacientů s absolutním pocitem lymfocytů 0,5 × 109 /l nebo/a absolutním počtem neutrofilů 1 × 109 /l a méně a výrazně anemických pacientů s hodnotou hemoglobinu nižším než 80 g/l. Vzhledem k eliminaci ledvinami je u pacientů s renální insuficiencí (clearance kreatininu 30–60 ml/min) je doporučená redukovaná dávka 2 mg/den. V populaci pacientů s mírnou hepatopatií není nutná úprava dávky.
Bezpečnost JAK inhibitorů je do jisté míry srovnatelná s bDMARD, nicméně jsou zde určité rozdíly ve vyšším výskytu infekce herpes zoster, kardiovaskulárních onemocnění, tromboembolických příhod, dyslipidemie a další laboratorní abnormality. Americká léková agentura (FDA) vydala soubor doporučení stran terapie JAK inhibitory, kterou následně převzala Evropská léková agentura (EMA). Nedoporučuje se podávat JAK inhibitory pacientům starším 65 let, pacientům se zvýšeným rizikem závažných kardiovaskulárních příhod (cévní mozková příhoda, náhlá srdeční smrt, infarkt myokardu), dlouhodobým kuřákům a pacientům se zvýšeným rizikem onkologických onemocnění.
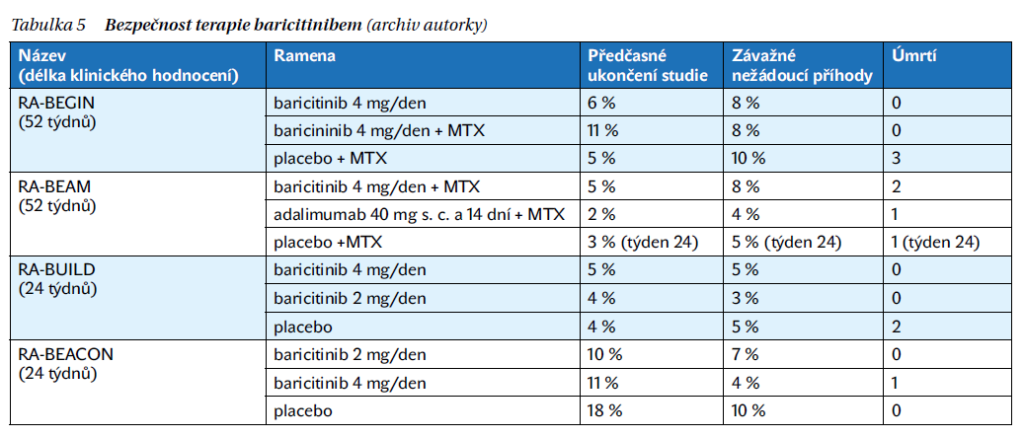
Doporučení EMA připouští možnost podávání JAK inhibitorů nemocným starším 65 let, pokud není dostupná vhodná alternativa. Alergická reakce je kontraindikací podávaní baricitinibu. U pacientů dostávajících kombinovanou terapii MTX s baricitinibem byla zaznamenána nauzea, nejčastěji v prvních 2 týdnech podávaní. Četnost infekcí byla vyšší ve skupinách, které dostávaly baricitinib, než u placeba. Mezi nejvíce hlášené nežádoucí příhody patřily infekce horních cest dýchacích, močových cest a gastroenteritida, dále závažné infekce herpes zoster a celulitida. Nepotvrdily se dosud obavy z rozvoje těžkých neutropenií, v průběhu studií byl pozorován reverzibilní pokles neutrofilů v 16. týdnu bez korelace s výskytem infekce. Byly zaznamenány příhody reverzibilní trombocytózy. Těsná kontrola je nutná u kombinované terapie baricitinib s MTX vzhledem k riziku rozvoje hepatopatie (tabulka 5).
Baricitinib v terapii revmatoidní artritidy
Baricitinib byl první JAK inhibitor schválený pro terapii RA v Evropské unii, nyní je již k dispozici v 75 zemích v této indikaci. Studie fáze II–III (RA-BALANCE, RA-BEGIN, RA-BEAM, RA-BUILD, RA-BEACON, RA-BEYOND) a více než sedmiletá data prokázaly dobrou efektivitu, rychlý nástup účinku za uspokojivého bezpečnostního profilu u baricitinibu (tabulka 6).
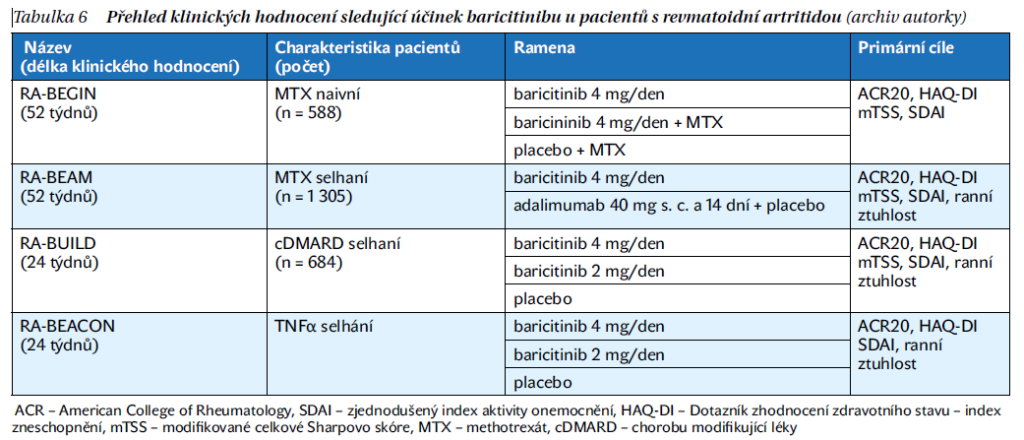
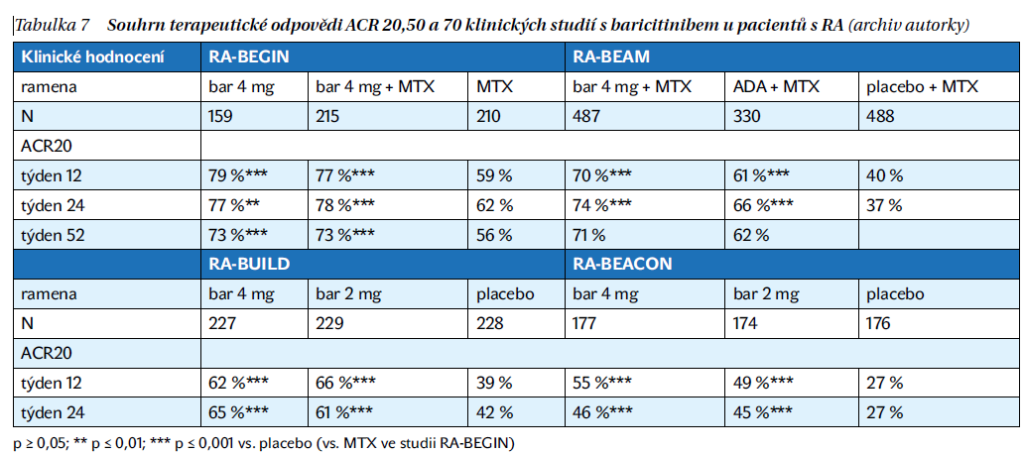
Studie RA-BEGIN porovnávala účinnost baricitinibu v dávce 4 mg/den v monoterapii nebo v kombinaci MTX proti placebu u pacientů s RA. Skupina s baricitinibem vykazovala lepší a rychlejší terapeutickou odpověď v týdnu 24 podle ACR20 proti monoterapii MTX. Rovněž v této skupině byla vyšší míra remise nebo alespoň nízké aktivity onemocnění proti MTX.
Studie RA-BALANCE, RA-BUILD a RA-BEAM byly studie fáze III u pacientů s aktivní RA, u kterých selhala předchozí terapie tradičními chorobu modifikujícími léky (csDMARD). Pacienti dostávající baricitinib dosáhli terapeutické odpovědi hodnocené podle ACR20 statisticky signifikatně ve větším počtu než v ostatních skupinách. Studie RA-BEAM srovnávala baricitinib s adalimumabem, kde baricitinib prokázal klinickou superioritu vůči adalimumabu s vyšším počtem pacientů, kteří dosáhli terapeutické odpovědi ACR20 a poklesu DAS28-CRP proti výchozí hodnotě (tabulka 7).
Studie RA-BEACON byla zaměřena na pacienty s RA, u kterých bylo dokumentováno selhání nebo nežádoucí účinky předchozí terapie bDMARD. U pacientů došlo významnému funkčnímu a klinickému zlepšení při léčbě baricitinibem proti placebu. Post hoc analýza uvádí, že baricitinib byl účinný a lepší než placebo bez ohledu na předchozí počet a typ souběžně užívaných bDMARDs nebo užívání glukokortikoidů (tabulka 7).
Baricitinib v ostatních revmatologických indikacích
Baricitinib se úspěšně etabloval v terapii RA a JAK1/2 inhibice se stala terapeutickým cílem klinických studií i v dalších revmatologických diagnózách, z nichž pouze JIA získala schválení v této indikaci. V současnosti probíhá celá řada klinických studií, včetně sběru dat z národních a nadnárodních registrů, hodnotících efektivitu a bezpečnost baricitinubu. Baricitininb byl použit jako off-label terapie např. u idiopatické myozitidy.
Juvenilní idiopatická artritida – studie fáze III zaměřená na dětské pacienty s JIA umožnila registraci baricitinibu v této indikaci. Pacienti dostávající baricitinib vykazovali statisticky signifikatně vyšší terapeutickou odpověď JIA-ACR30 ve 12 týdnu proti placebu. Rovněž relapsy JIA byly častější u placebové skupiny. Baricitinib je registrován pro terapii JIA.
Ankylozující spondylitida – radiografická (r-axSpA)/non-radiografická (nr-axSpA) – dosud nebyly publikovány studie s baricitinibem. Předpokládá se, že selektivní inhibice JAK1/JAK2 není vzhledem k patogenetickým mechanismům podílejícím se na vzniku/průběhu tak efektivní jako inhibice JAK1/JAK3. Baricitinib není v současné době schválen v této indikaci.
Psoriatická artritida – dosud nebyly publikovány studie s baricitinibem. Baricitinib není v současné době schválen v této indikaci.
Systémový lupus erythematodes (SLE) – klinické studie fáze III BRAVE-I a BRAVE-II byly zaměřeny na pacienty se SLE. Studie fáze II SLE-BRAVE I dosáhla primárního cíle hodnotit terapeutickou odpověď u SLE a umožnila zahájení studie fáze III SLE-BRAVE II. SLE-BRAVE II nepotvrdila výsledky SLE-BRAVE I. Bezpečnostní profil baricitinibu se rámcově nelišil u pacientů se SLE proti datům získaným se studií s RA. Baricitinib není v současné době schválen v indikaci SLE.
Závěr
Inhibice JAK 1/2 prostřednictvím bariticinibu se etablovala v terapii RA a JIA v revmatologii, ale i v dermatologii (alopecia areata a další). Baricitinib má schopnost negativně ovlivnit intracelulární transdukci vedoucí k poklesu produkce prozánětlivých cytokinů v patogenezi RA a JIA. Bariticinib má výhodu oproti csDMARD a bDMARD v téměř okamžitém nástupu a dobré retenci na terapii u nemocných. FDA a EMA vydaly doporučení pro bezpečnost vycházející z klinických sledovávání, post hoc analýz a dat získaných s pacientských registrů. V rámci terapie JAK inhibitory je nutné zvážit benefit proti eventuálním rizikům léčby. Baricitinib je užíván nejen v revmatologii, ale i v dermatologii a předpokládá se, že se v budoucnu rozšíří další indikace, u kterých je používán zatím off-label v rámci kazuistických sdělení.
Literatura u autorky.
doc. Ing. et Mgr. Blanka Stibůrková, Ph.D.
Oddělení molekulární biologie a imunogenetiky
Revmatologický Ústav, Praha a Revmatologická klinika 1. LF UK Praha
