Bronchogenní karcinom je onemocněním s nepříznivou prognózou, které je často v době diagnózy již pokročilé, metastazující. U nemalobuněčného karcinomu plic (NSCLC – non-small cell lung carcinoma) je v důsledku lepšího porozumění molekulární biologii nádorů dosahováno zlepšení léčebných výsledků cílenou léčbou, podávanou na základě genetických změn nádoru, které nám predikují účinnost této terapie. Další léčebnou modalitou je imunoterapie, jež svou účinnost potvrdila i v kombinaci s chemoterapií. Samotná chemoterapie již přestává být standardem léčby v 1. linii pokročilého NSCLC.
Klíčová slova: nemalobuněčný karcinom plic, cílená léčba, imunoterapie, cytotoxická léčba.
ÚVOD
Nejlepší prognózu mají pacienti, jejichž onemocnění je diagnostikováno v časném, operabilní stadiu. U lokálně pokročilého onemocnění je pak pro pacienty přínosem multidisciplinární přístup včetně radioterapie. Pro určení optimálního léčebného postupu je proto nezastupitelná role multidisciplinárního týmu, jehož členy jsou lékaři různých odborností (pneumolog, chirurg, pneumoonkolog, radioterapeut, radiodiagnostik, patolog).
Při rozhodování o léčbě bronchogenního karcinomu na prvním místě zůstává morfologická diagnóza. NSCLC tvoří více než 80 % bronchogenních karcinomů, nejčastěji se jedná o adenokarcinom, skvamózní a velkobuněčný karcinom. NSCLC je geneticky velmi nehomogenní skupinou nádorů a pacienti se stejným morfologickým typem nádoru mohou mít různé odpovědi na stejný protinádorový lék. S neustálým pokrokem v technologii biologické detekce se rozšiřují možnosti molekulární typizace lidského genomu, což umožňuje také precizní a personalizovanou léčbu především neskvamózního NSCLC na základě zjištěných genetických změn. V České republice se standardně vyšetřují mutace genu EGFR, přestavba genů ALK a ROS1. S přibývající léčebnými možnostmi se v řadě mezinárodních doporučení rozšiřuje testování nádorové tkáně o další genetické změny (BRAF, NTRK, MET, RET, HER2, KRAS aj.). S nástupem imunoterapie je vyšetřována i exprese ligandů PD-L1, případně mutační nálož nádoru – TMB (tumor mutation burden). Využití tekutých biopsií, jež umožňují vyšetření cirkulující nádorové DNA (ctDNA) z plasmy je vhodné zvláště v případech, kdy nádorová tkáň není dostupná a chceme například vyšetřit přítomnost rezistentní mutace T790M. Senzitivita tohoto vyšetření je ale nižší než při vyšetření bioptované tkáně.
Cílená léčba
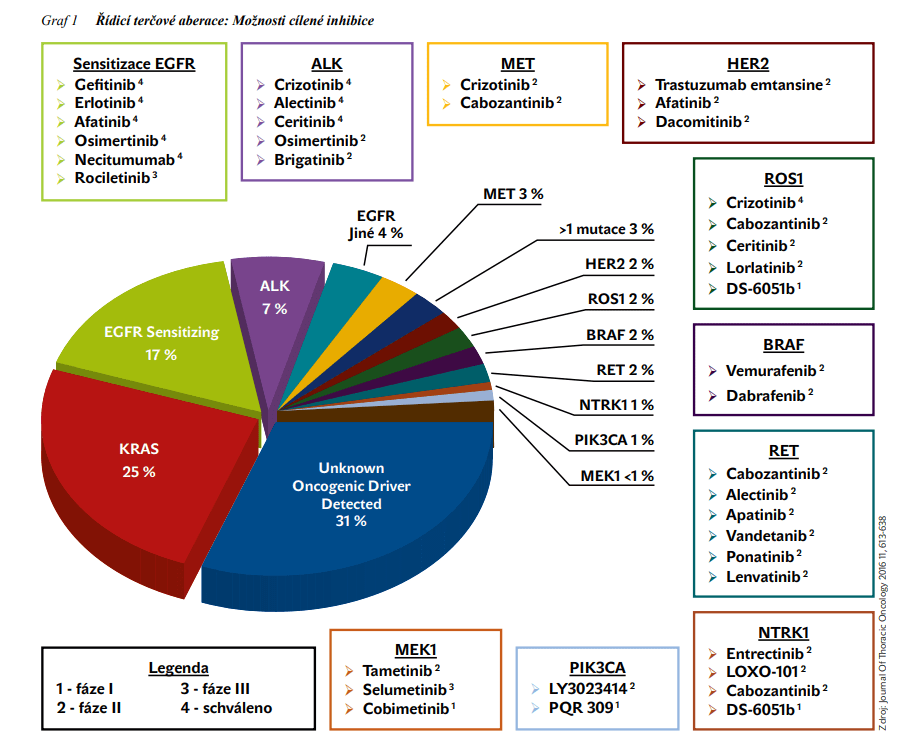
Cílená léčba působí na nádorovou buňku na subcelulární úrovni s cílem ovlivnit signální dráhy u nádorů s určitými genetickými změnami. Ovlivněny jsou tak základní regulační funkce buněk – proliferace, diferenciace, migrace, angiogeneze, apoptóza. V současné době přibývá počet identifikovaných genových aberací a rozšiřuje se možnost jejich ovlivnění cílenou léčbou (viz obrázek 1).
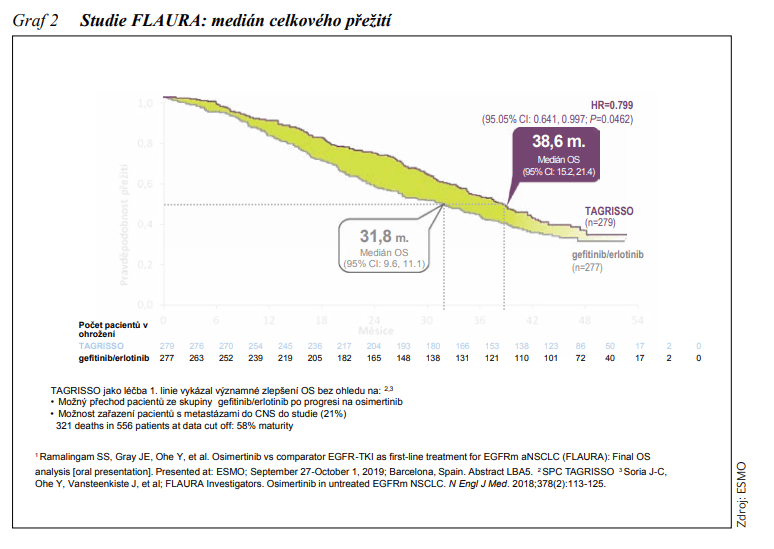
Při přítomnostiaktivačních mutací v exonu 18 až 21 genu EGFR je indikována léčba inhibitory tyrosinkinázy (TKI – tyrosine kinase inhibitor) receptoru epidermálního růstového faktoru (EGFR – epidermal growth factor receptor). V asijské populaci je mutace EGFR přítomna asi u 40 %, v bělošské asi u 10 – 15 % pacientů s NSCLC, především adenokarcinomem. V současné době máme k dispozici již 3 generace TKI EGFR – reversibilní TKI EGFR 1. generace – erlotinib a gefitinib, a ireversibilní TKI EGFR 2. generace – afatinib a dacomitinib a 3. generace osimertinib. Nejlepší léčebné výsledky jsou dosahovány u delece v exonu 19, o něco horší pak u mutace L858R exonu 21. Tyto dvě mutace jsou nejčastější a ve většině publikovaných prací zaujímají 75 – 80 %.Při léčbě TKI EGFR však musíme počítat se vznikem získané rezistence. Průměrná doba do jejího vzniku se udává 12 měsíců. Mechanismy jejího vzniku jsou různé, nejčastěji (až v 60 %) se jedná o mutaci T790M v exonu 20, další jsou pak např. amplifikace genu MET, amplifikace genu HER2, nebo fenotypická transformace v malobuněčný karcinom či přechod buněk z epiteliálního fenotypu na mesenchymální. Jsou proto vyvíjeny TKI EGFR vyšších generací zaměřené na rezistentní mutace včetně T790M. Osimertinib jeselektivní ireversibilní TKI EGFR 3. generace, u něhož byla prokázána účinnost u pacientů s NSCLC s aktivačními mutacemi a mutací T790M, jež jsou rezistentní k léčbě TKI EGFR 1. a 2. generace. Ve studii fáze III FLAURA byl osimertinib porovnáván s TKI EGFR 1. generace gefitinibem či erlotinibem v 1. linii léčby u pacientů s aktivační mutací EGFR v exonu 19 nebo 21.Doba přežívání bez progrese (PFS – progression-free survival) byla ve větvi s osimertinibem 18,9 vs. 10,2 měsíců (HR: 0,46; 95% CI: 0,37 – 0,57; P <0,001). Do studie mohli být zařazeni i pacienti se stabilizovanými metastázami CNS. Při léčbě osimertinibem bylo méně progresí v CNS, snížilo se riziko progrese do CNS o 52 % (HR: 0,48; 95% CI: 0,26 – 0,86; P = 0,014), odpovědi v CNS byly setrvalé, v porovnání s pacienty ze skupiny komparátoru TKI EGFR. Při progresi onemocnění a prokázané mutaci T790M mohli pacienti ze skupiny komparátoru TKI EGFR přejít na léčbu osimertinibem. Medián celkové doby přežití (OS – overall survival) byl 38,6 měsíců (95% CI: 34,5 – 41,8) ve větvi s osimertinibem, 31,8 měsíců (95% CI: 26,6 – 36,0) v porovnávací větvi (HR: 0,799; 95% CI: 0,641 – 0,997; P = 0,0462). Jedná se tak o jedinou léčbu TKI EGFR v první linii léčby NSCLC, při níž medián OS přesahuje 3 roky (viz obrázek 2). Podle mezinárodních doporučení je preferovanou léčbou první linie u pacientů s prokázanou aktivační mutací genu EGFR, schválenou EMA (European Medicines Agency) v 6/2018. V České republice je od 2/2019 stanovena úhrada pouze při progresi na léčbě TKI EGFR nižší generace a prokázané mutaci T790M. Ovšem i při léčbě inhibitory TKI EGFR 3. generace musíme očekávat vznik rezistence, která má řadu příčin, například amplifikace genu MET, získaná mutace C797S v genu EGFR, a další. Probíhají proto již studie zaměřené na překonání rezistence.
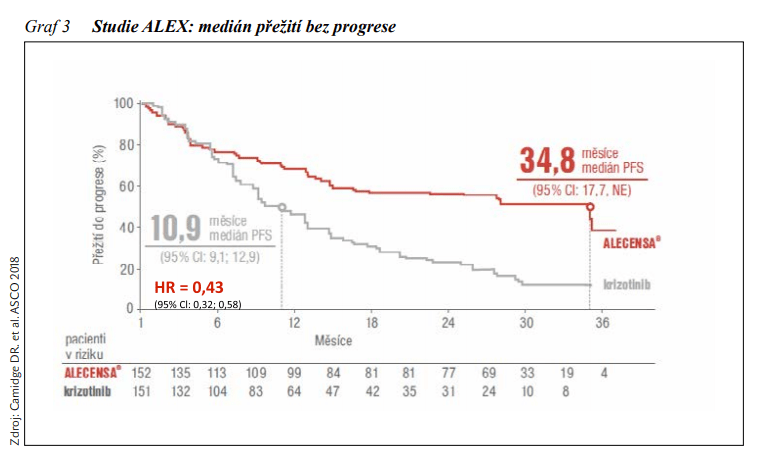
Přestavba genu ALK je prediktorem účinnosti inhibitorů ALK (anaplastic lymphoma kinase). Její výskyt je vzácný, udává se okolo 3 – 5 % pacientů s NSCLC, často u mladších, lehkých kuřáků nebo nekuřáků s adenokarcinomem, s mírnou převahou žen. Crizotinib, multikinázovýinhibitor 1. generace s účinností na signální dráhy aktivované ALK, c-MET (receptor pro hepatocytární růstový faktor) a ROS1 sice změnil léčebné schéma u ALK-pozitivních pacientů s pokročilým NSCLC, avšak v důsledku vzniku rezistence musíme v průměru během 1 – 2 let počítat s progresí onemocnění. K překonání rezistence jsou vyvíjeny inhibitory ALK vyšších generací. Inhibitory ALK 2. generace mají obecně větší selektivitu, účinnost a průnik do CNS, a také jsou schopné překonat některé mutace, jež vedou k rezistenci na crizotinib. Schváleny a zmiňovány v mezinárodních doporučeních jsou alectinib, ceritinib, brigatinib, inhibitor ALK a ROS1 3. generace lorlatinib. Alectinib je inhibitor tyrosinkinázy ALK a RET 2. generace vykazující dobrou účinnost v CNS. Nyní je již standardem prvoliniové léčby ALK-pozitivního NSCLC. Jeho superiorita byla hodnocena v klinické studii fáze III ALEX, v níž byl porovnáván alectinib s crizotinibem. Studie prokázala snížení rizika progrese o 57 % a významné prodloužení mediánu PFS u alectinibu na 34,8 měsíců proti 10,9 měsícům při léčbě crizotinibem (viz obrázek 3). K významnému prodloužení mediánu PFS došlo i u pacientů s metastázami CNS při vstupu do studie (27,7 měsíců při léčbě alectinibem a 7,4 měsíců při léčbě crizotinibem) s 84% snížením rizika progrese do CNS. Od 1. 11. 2019 je i v České republice alectinib hrazeným standardem prvoliniové léčby pacientů s ALK-pozitivním NSCLC bez ohledu na přítomnost či nepřítomnost metastáz CNS v okamžiku zahájení léčby s tím, že více než trojnásobně prodlužuje PFS v porovnání s crizotinibem. Lorlatinib je selektivní TKI ALK/ROS1 3. generace s dobrým průnikem do CNS, jenž prokázal svou aktivitu vůči většině rezistentních mutací, včetně G1202R. 7. 5. 2019 byl lorlatinib v monoterapii schválen EMA k léčbě dospělých pacientů s pokročilým ALK-pozitivním NSCLC, u nichž došlo k progresi onemocnění po léčbě alectinibem nebo ceritinibem, nebo po léčbě crizotinibem a nejméně jedním dalším TKI ALK.
Gen ROS1 je transmembránový gen tyrosinkinázové rodiny inzulinových receptorů, umístěný na q21 chromozomu 6. Jeho přestavba se vyskytuje vzácně, asi u 1 – 2 % NSCLC, především u mladých žen, nekuřaček s adenokarcinomem. Až u 40 % pacientů s ROS1-pozitivním NSCLC nacházíme mozkové metastázy již při diagnóze onemocnění, a u zbývající skupiny pacientů často dochází k progresi do CNS v dalším průběhu onemocnění. U pacientů s přestavbou genu ROS1 byla prokázána účinnost crizotinibu, ceritinibu, lorlatinibu a entrectinibu. Entrectinib je selektivní inhibitorNTRK/ROS1/ALK s prokazatelnou aktivitou v CNS, který je cíleně vyvinut tak, aby překonával hematoencefalickou bariéru. V in vitro testech prokázal entrectinib 30x vyšší aktivitu než crizotinib. V klinických studiích u 53 dosud neléčených ROS1-pozitivních pacientů byla celková léčebná odpověď (ORR – overall response rate) 79,2 %, z toho u podskupiny pacientů s metastázami CNS při vstupu do studie činila ORR 73,9 %. K datu uzavření sběru údajů (medián sledování 15,5 měsíců) byl dosažen medián PFS v délce 19,0 měsíců (95%Cl: 12,2 – 36,6). V roce 2019 byl entrectinib schválen FDA pro léčbu ROS1-pozitivních NSCLC a solidních nádorů s fúzí genů NTRK, ve stejné indikaci pak EMA v 7/2020. V České republice je nyní dostupný v rámci specifického léčebného programu u ROS1-pozitivních pacientů s prokázaným metastatickým postižením CNS, čímž rozšiřuje léčebné možnosti těchto pacientů.
Imunoterapie
Další možností v léčbě bronchogenního karcinomu, která se již dostala do klinické praxe, je imunoterapie. Ta není zaměřená na samotný nádor, ale na imunitní systém pacienta. Cílem léčby jsou povrchové antigeny přítomné na nádorových buňkách, přičemž strategie založená na protilátkách inhibujících řídicí body imunitní reakce může výrazně zlepšit protinádorovou imunitní odpověď. Klinickou účinnost prokázaly monoklonální protilátky blokující CTLA-4 (cytotoxický T-lymfocytární antigen) a receptor PD-1 (protein programované buněčné smrti) a jeho ligand PD-L1. Uspokojivě však není vyřešena otázka prediktivních biomarkerů. Jedním z prediktorů účinnosti, jenž se standardně používá v klinické praxi, je exprese PD-L1 na nádorových buňkách, i když víme, že se může lišit v různých částech nádoru či metastáz. Dalším možným prediktorem účinnosti, jenž budí zájem, je mutační nálož nádoru – TMB.
Imunoterapie byla nejprve schválena ve 2. a vyšší linii léčby NSCLC při progresi po předchozí léčbě platinovým dubletem a nepřítomnosti řídicích mutací. Na základě výsledků studií fáze III CheckMate-017 (skvamózní NSCLC) a CheckMate-057 (neskvamózní NSCLC) byl schválen nivolumab, který vedl ke zlepšení ORR, OS, PFS v porovnání s docetaxelem bez ohledu na míru exprese PD-L1 (v České republice schválena úhrada od r. 2018). Atezolizumab je ve stejné indikaci schválen na základě výsledku studie fáze III OAK (trvalá úhrada pro oba histologické typy v ČR od 1.3.2020) a pembrolizumab na základě studie fáze II/III KEYNOTE-010 u pacientů s prokázanou expresí PD-L1 nad 1 %.
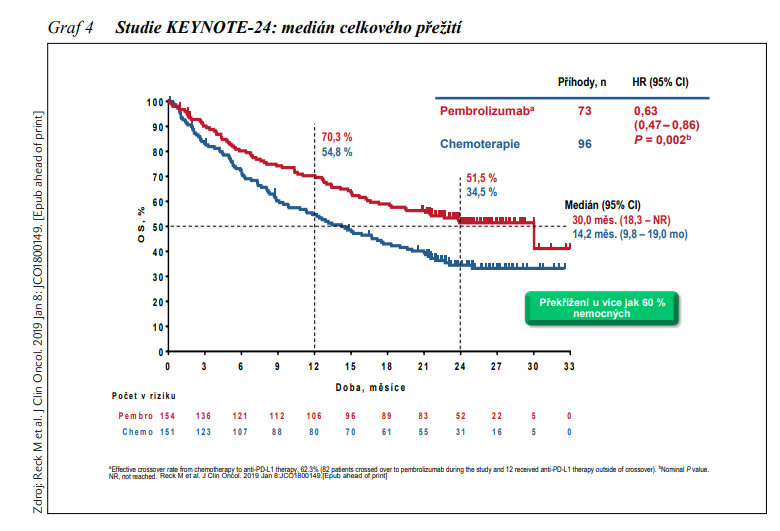
V monoterapii v 1. linii léčby metastazujícího NSCLC u pacientů, jejichž nádory vykazují vysokou expresi PD-L1 ≥50 % je standardem léčby na základě výsledků studie fáze III KEYNOTE-024 pembrolizumab. ORR v této studii byla 44,8 % (95% CI: 36,8 – 53,0) u pacientů ve skupině léčené pembrolizumabem v porovnání s 27,8 % (95% CI: 20,8 – 35,7) ve skupině s chemoterapií. Aktualizované výsledky s mediánem sledování 25,2 měsíců potvrdily přínos léčby pembrolizumabem v porovnání s chemoterapií, medián OS ve větvi s pembrolizumabem byl 30,0 měsíců (95% CI:18,3 – NR) v porovnání se 14,2 měsíci (95% CI:9,8 – 19,0) ve větvi s chemoterapií (HR: 0,63; 95% CI: 0,47 – 0,86), P = 0,002 (viz obrázek 4). V této indikaci je i v České republice od 1. 3. 2019 stanovena úhrada pembrolizumabu z veřejného zdravotního pojištění.
Na ASCO 2019 byly předneseny údaje, jež potvrzují dlouhodobý přínos léčby imunoterapií pembrolizumabem. Pětiletá OS ve studii KEYNOTE-001, multikohortové studii fáze 1b, v níž kohorta G zahrnovala 550 pacientů s NSCLC dosud neléčených i předtím již léčených, byla u pacientů s vysokou expresí PD-L1 (≥50 %) 29,6 %.
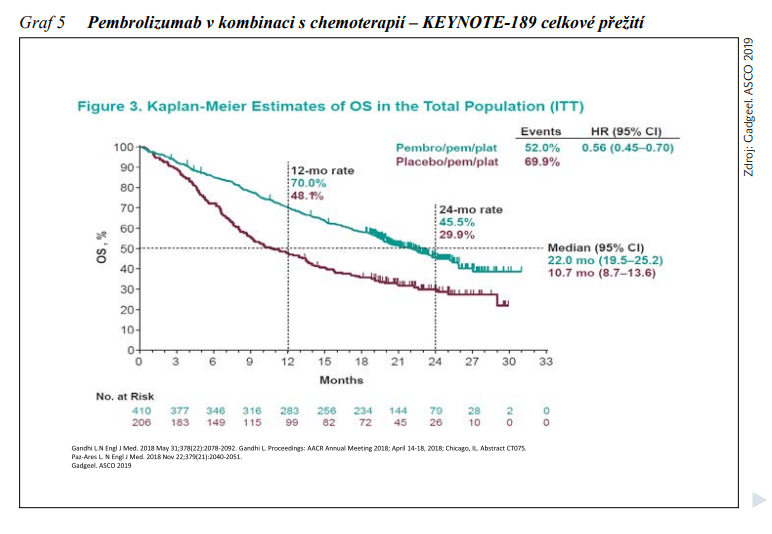
Úhrada kombinace imunoterapie + chemoterapie v léčbě metastazujícího neskvamózního i skvamózního NSCLC u pacientů s expresí PD-L1 1 – 49 % byla v České republice schválena 1. 8. 2020. U neskvamózního NSCLC na základě studie fáze III KEYNOTE-189, v níž byli pacienti bez mutace EGFR či ALK, kteří nebyli dosud léčeni, náhodně přiřazeni buď k léčbě pemetrexedem a platinovým derivátem v kombinaci s pembrolizumabem, nebo k podávání placeba, každé tři týdny v počtu 4 cyklů, s následnou léčbou pembrolizumabem nebo placebem až do dosažení 35 cyklů spolu s udržovací léčbou pemetrexedem. Ve větvi s placebem bylo při prokázané progresi onemocnění povoleno přeřazení na monoterapii pembrolizumabem. Aktualizované výsledky této studie přednesené na kongresu ASCO 2019 ukázaly medián OS ve větvi s pembrolizumabem 22,0 měsíců (95% CI: 19,5 – 25,2) v porovnání s 10,7 měsíci (95% CI: 8,7 – 13,6) při léčbě chemoterapií samotnou (HR: 0,56, 95% CI: 0,45 – 0,70) (viz obrázek 5). Účinnost kombinované léčby u skvamózního NSCLC byla hodnocena ve studii fáze III KEYNOTE-407, v níž byla porovnávána účinnost kombinace pembrolizumabu s chemoterapií karboplatina + paclitaxel nebo nabpaclitaxel s chemoterapií samotnou. Studie prokázala ve větvi s pembrolizumabem signifikantní zlepšení OS (HR: 0,64), a to bez ohledu na expresi PD-L1. Rovněž PFS bylo výrazně lepší ve větvi s pembrolizumabem (HR: 0,56). ORR byl 58,4 % vs. 35,0 % (P = 0,0004).
Ve studii fáze III IMpower150 byla prokázána účinnost kombinace atezolizumab, bevacizumab a chemoterapie karboplatina a paclitaxel. Medián OS byl delší v porovnání se skupinou bez imunoterapie (19,2 vs. 14,7 měsíců, HR: 0,78; 95% CI: 0,64 – 0,96; P = 0,02). V pozdější analýze dvou podskupin pacientů byla prokázána jasná superiorita této léčebné kombinace i u pacientů s mutacemi EGFR či ALK a metastatickým postižením jater. Účinnost kombinace byla prokázána ve všech podskupinách pacientů bez ohledu na míru exprese PD-L1. Na základě této studie byla tato léčebná kombinace schválena EMA v 4/2019 pro prvoliniovou léčbu pacientů s neskvamózním NSCLC, včetně pacientů s prokázanou aktivační mutací EGFR a přestavbou ALK po selhání cílené léčby.
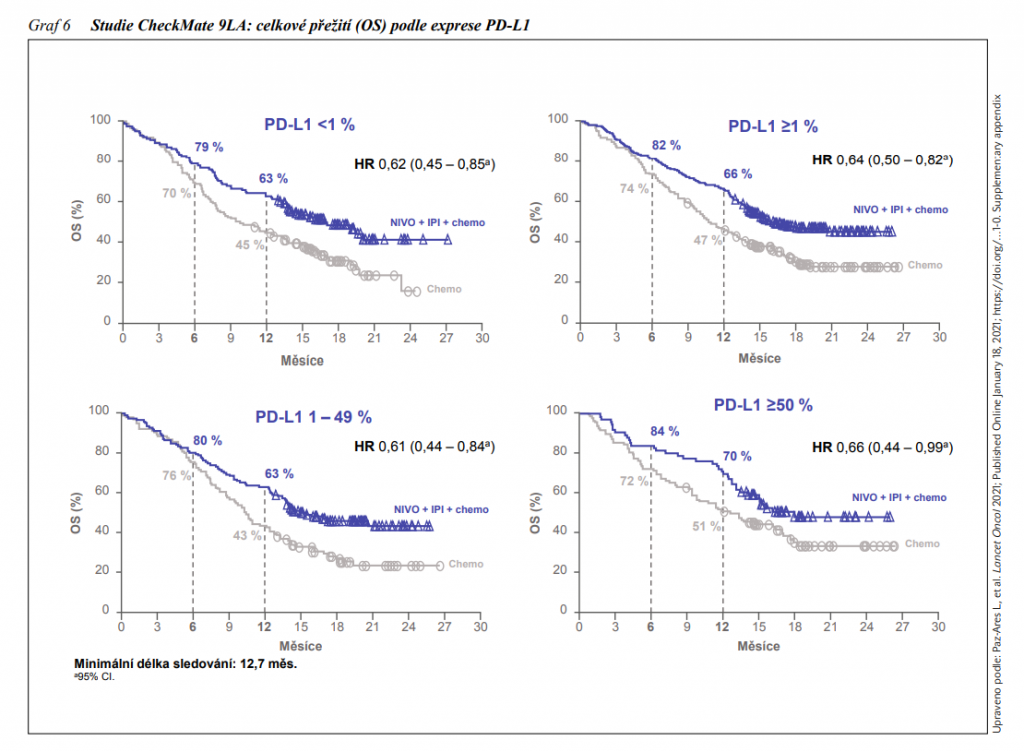
Na virtuální konferenci ASCO 2020 byly předneseny výsledky studie fáze III CheckMate 9LA, v níž byla hodnocena kombinace imunoterapie nivolumab + ipilimumab + 2 cykly chemoterapie v porovnání s chemoterapií v 1. linii metastazujícího NSCLC. Při sledování minimálně 12,7 měsíců byla ve větvi NIVO + IPI + chemo delší OS v porovnání s větví s chemoterapií, medián 15,6 vs. 10,9 měsíců (HR: 0,66, 95% CI: 0,55 – 0,80). Míra jednoleté OS byla 63 % vs. 47 %. Délka trvání odpovědí byla ve prospěch kombinovaného režimu (11,3 vs. 5,6 měsíců). Po 12 měsících sledování mělo stále odpověď 49 % pacientů léčených kombinací a 24 % léčených samotnou chemoterapií. Medián trvání terapie byl 6,1 (0 – 23,5) měsíců pro kombinaci a 2,4 (0 – 24,0) měsíce pro chemoterapii. Klinický přínos byl konzistentní ve všech podskupinách, nezávisle na expresi PD-L1 a nezávisle na histologii. EMA schválila tuto léčebnou kombinaci v 9/2020. Pacientům bez ohledu na míru exprese PD-Ll, tedy i negativním, se tak nabízí nová slibná léčebná možnost.
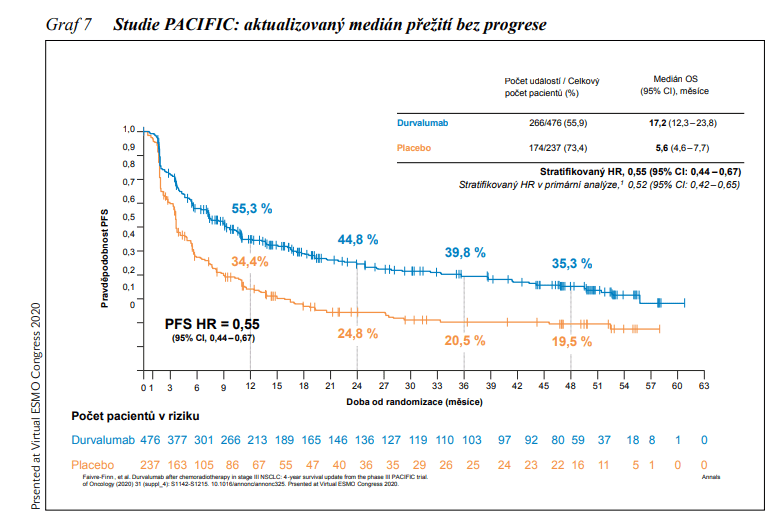
Imunoterapie se postupně posouvá i do léčby nižších stadií NSCLC. Ve studii fáze III PACIFIC byla pacientům ve stadiu III NSCLC, u nichž nedošlo k progresi po chemoradiační léčbě na bázi platiny, podávána konsolidační léčba durvalumabem vs. placebo. Medián PFS od randomizace byl 17,2 měsíců (95% CI: 13,1 – 23,9) ve větvi s durvalumabem, vs. 5,6 měsíců (95% CI: 4,6 – 7,7) ve větvi s placebem (HR: 0,51; 95% CI: 0,41 – 0,63; P <0,001) (viz obrázek 6). Po 12 měsících bylo dosaženo PFS u 55,7 % vs. 34,4 %, po 18 měsících u 49,5 % pacientů ve větvi s durvalumabem vs. 26,7 % ve větvi s placebem. V nedávné analýze po 48 měsících přežívá 49,6 % pacientů ve větvi s durvalumabem a 36,3 % ve větvi s placebem. V této analýze byl poprvé vyčíslen medián OS pro durvalumab, jenž dosáhl hodnoty 47,5 měsíců vs. 29,1 měsíců ve větvi s placebem. Riziko úmrtí bylo sníženo o 29 % (HR: 0,71; 95% CI: 0,57 – 0,88). Bez progrese onemocnění přežívá po 48 měsících 35,3 % léčených durvalumabem v porovnání s 19,5 % pacientů užívajících placebo. Durvalumab je od září 2018 schválen EMA a v České republice je od 1. 1. 2021 hrazen v monoterapii k léčbě dospělých pacientů s lokálně pokročilým, neoperovatelným NSCLC s expresí PD-L1 na ≥1 % nádorových buněk, u kterých nedošlo k progresi onemocnění po konkomitantní chemoradiační léčbě na bázi platiny. Rozšiřuje tak indikaci imunoterapie do stadia III s potenciálně kurativním účinkem léčby.
Cytotoxická léčba
V současné době se indikace samotné chemoterapie zužuje na případy, kdy není zjištěna některá z genetických aberací, při níž je indikována cílená léčba, a nesplňuje-li pacient kritéria léčby imunoterapií. Výsledky samotné chemoterapie však nejsou uspokojivé, průměrná OS se při léčbě platinovým dubletem s cytostatiky 3. generace (paclitaxel, gemcitabin, vinorelbin, docetaxel) pohybuje okolo 8 – 10 měsíců. Víme, že léčebné výsledky jsou ovlivněny prognostickými a prediktivními faktory. Za jeden z prediktivních faktorů je na základě výsledku studií s cytotoxickou léčbou považována histologie. Význam histologie byl prokázán ve studiích s chemoterapií pemetrexedem, jež ukázaly jeho větší účinnost u adenokarcinomu.
ZÁVĚR
Léčba NSCLC zaznamenala v posledních letech výrazný pokrok. Je důležité stále klást důraz na genetické testování nádorů, neboť především sekvenování nové generace (NGS – next generation sequencing) nám umožňuje identifikovat, především u neskvamózních NSCLC, řadu genetických změn, jež jsou prediktory odpovědi na cílenou léčbu. Ani touto léčbou však naše pacienty vzhledem ke vzniku rezistence na cílenou terapii vyléčit neumíme, často je ale dosahováno léčebných odpovědí, jež mohou trvat řadu měsíců či let a můžeme tak mluvit o chronickém průběhu onemocnění. Rovněž u pacientů, kteří dosáhnou při imunoterapii léčebné odpovědi či stabilizace onemocnění, můžeme hovořit o chronickém průběhu, což je dobře patrné ze separace křivek OS ve prospěch imunoterapie, kterou jsme do této doby při žádné jiné léčbě pokročilého NSCLC neviděli. Probíhají také studie s imunoterapií u časnějších stadií NSCLC s neoadjuvantním či adjuvantním záměrem, s cílem zlepšit operabilitu a snížit riziko recidiv. Význam samostatné chemoterapie se tak začíná omezovat na NSCLC, u kterých nejsou indikovány výše zmíněné léčebné modality. Nezbytný je tedy individualizovaný výběr optimální léčby pro každého pacienta.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00064203 FN Motol.
Literatura k dispozici u autora.
MUDr. Leona Koubková
Pneumologická klinika UK 2 LF a FN Motol, Praha