Dna představuje heterogenní skupinu metabolických onemocnění, pro kterou je charakteristická tvorba a ukládání depozit krystalů natrium urátů v různých tkáních. Hyperurikémie je nejvýznamnějším ovlivnitelným rizikovým faktorem vývoje dny. Její přítomnost představuje rovněž významné riziko pro vznik některých kardiovaskulárních onemocnění, diabetes mellitus 2. typu, onemocnění ledvin a rovněž pro zvýšenou celkovou a kardiovaskulární mortalitu.
Diabetes mellitus 2. typu (DM2) je heterogenní metabolické onemocnění projevující se hyperglykémií. Na jeho vzniku se podílí kombinace inzulinové deficience a inzulinové rezistence. Zvýšené sérové hladiny kyseliny močové lze detekovat již v časných stadiích poruchy glukózového metabolismu. Předpokládá se, že inzulinová rezistence je hlavním rizikovým faktorem pro rozvoj metabolického syndromu (MetS), který je charakterizován přítomností poruchy metabolismu glukózy, centrálního typu obezity, hypertenze, aterogenní dyslipidémie, ale rovněž hyperurikémie a protrombotického stavu. Mezi těmito chorobami a metabolickými odchylkami existuje řada na sobě závislých vazeb, které vedou ke zvýšení jejich incidence a přispívají i ke zvýšení celkové a kardiovaskulární mortality. Léčba hyperurikémie vede nejen k potlačení příznaků dny, ale může i přispět ke snížení rizika vývoje přidružených onemocnění a ke snížení celkové a KV mortality u pacientů s DM 2. typu.
Z klinické praxe víme, že se MetS, DM2, hyperurikémie a dna často vyskytují společně. V posledních několika letech se mnohá sledování snaží vysvětlit a prozkoumat vzájemný vztah mezi těmito chorobami a metabolickými odchylkami.
Riziko vývoje dny narůstá se zvyšující se sérovou hladinou kyseliny močové
Prevalence hyperurikémie v populaci je udávána v rozsahu 4 až 40 %. Prospektivní hodnocení, které sledovalo 2046 zdravých dobrovolníků po dobu 14,9 roku, prokázalo významný nárůst incidence dny v závislosti na výši urikémie. Zatímco roční incidence dny ve skupině osob s urikémií nižší než 416 μmol/l činila 0,1 %, ve skupině osob s urikémií nad 530 μmol/l narostla na 4,9 %. Incidence dny byla v této práci rovněž 3x vyšší u nemocných s hypertenzí oproti normotenzním jedincům. Mezi další prediktivní faktory vývoje dny, které nebyly nezávislé na výši urikémie, patřily kromě hypertenze věk, hodnota body mass indexu (BMI), sérová hladina cholesterolu a konzumace alkoholu.
Kyselina močová je u člověka konečným produktem metabolismu purinů exogenního i endogenního původu, které jsou prostřednictvím enzymatické kaskády metabolizovány na hypoxanthin a xanthin a za přispění enzymu xanthinoxidáza (XO) na výsledný produkt kyselinu močovou. U většiny savců, s výjimkou lidí a primátů, tvoří součást jejich enzymatické výbavy i enzym urikáza, který katalyzuje přeměnu kyseliny močové na dobře rozpustný alantoin. Lidé a primáti proto mají vyšší sérové hladiny kyseliny močové ve srovnání s většinou savců. Role kyseliny močové v organismu je ambivalentní. V její struktuře jsou obsaženy labilní elektrony, a proto má značný oxidačně redukční potenciál. Na jedné straně je kyselina močová významných antioxidantem schopným vychytávat volné kyslíkové radikály a na druhé straně může být zdrojem urátových reaktivních forem kyslíku (např. urátový anion, aminokarbonyl). Bylo prokázáno, že v určitých situacích (zánět, ischemie) dochází ke zvýšení exprese enzymu XO v makrofázích a endoteliálních buňkách. Nadprodukce kyseliny močové může přispět k navození oxidačního stresu, který se podílí na rozvoji endoteliální dysfunkce a předčasné aterosklerózy (obrázek 1).
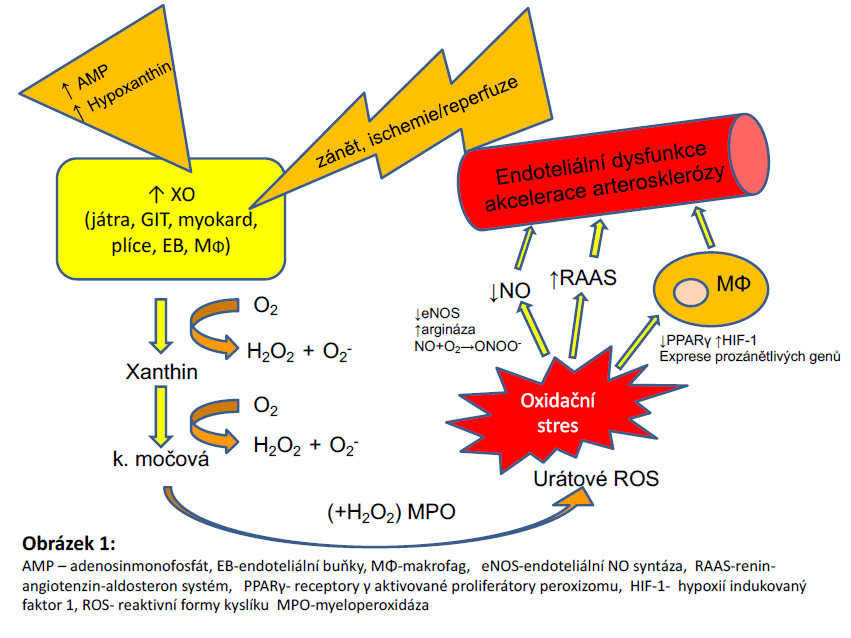
Prevalence dny ve vyspělých zemích se pohybuje mezi 1–2 % a významně narůstá s věkem. Muži bývají dnou postiženi 4–9x častěji než ženy. Prevalence dny v posledních desetiletích významně narůstá. Například data získaná ze dvou národních průzkumů zdravotního stavu obyvatelstva USA (NHANES III) prováděná v letech 1988 až 1994 a 2007 až 2008 prokázala, že se prevalence dny v tomto období zvýšila o 1,2 % a prevalence samotné hyperurikémie vzrostla dokonce o 3,2 %. V letech 2007–2008 byla hyperurikémie prokázána u 21,1 % mužů a 4,7 % žen a dnou trpělo 5,9 % mužů a 2,0 % žen. Mezi nejčastěji uváděné příčiny nárůstu prevalence hyperurikémie a dny patří zvyšující se průměrný věk, častější onemocnění ledvin, narůstající prevalence obezity, změna stravovacích návyků nebo extenzivní používání některých léků, zejména diuretik.
Hyperurikémie, dna, DM2 a kardiovaskulární riziko
Mezi hyperurikémií a dnou na jedné straně a DM 2. typu a MetS na druhé straně existuje řada na sobě závislých vazeb, které vedou ke zvýšené incidenci těchto onemocnění a přispívají ke zvýšení celkové a KV mortality (obrázek 2).
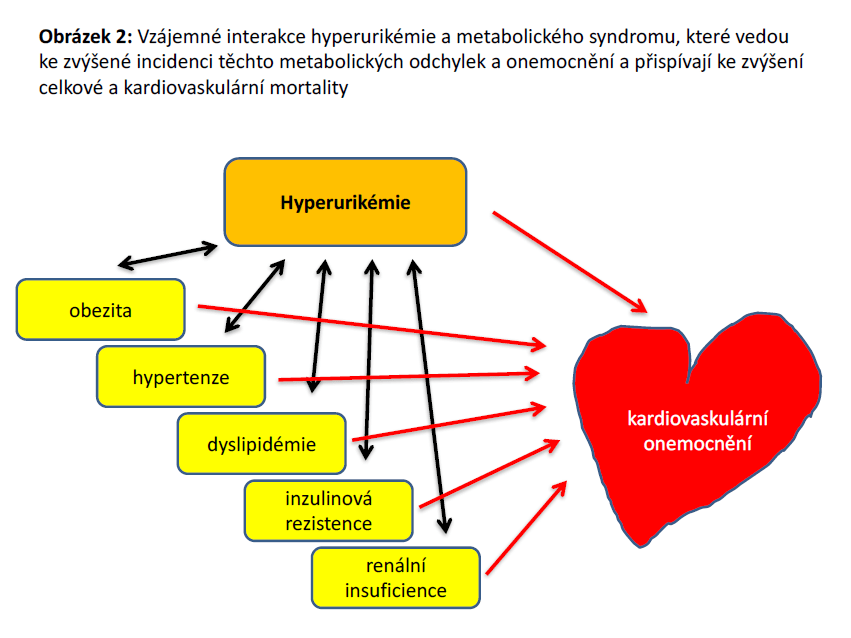
Studie španělských autorů, kteří sledovali 394 pacientů s dnou v průběhu 14 let, prokázala, že prevalence některých přidružených onemocnění zahrnujících dyslipidémii, hypertenzi, chronické onemocnění ledvin (CKD) nebo DM v průběhu onemocnění významně narůstá.
Rovněž prevalence MetS je u jedinců s hyperurikémií a dnou významně vyšší. Sledování 8807 osob starších 20 roků zařazených do NHANES III, prováděného v USA v létech 1988 až 1994, prokázalo rozdíl v prevalenci MetS mezi jedinci s dnou a bez dny (62,8 vs. 25,4 %). Riziko vývoje MetS u pacientů s dnou bylo zvýšeno téměř 5násobně (OR 4,96; 95% CI 3,17–7,75).
V práci italských autorů byl sledován vztah mezi sérovou hladinou kyseliny močové, MetS a ostatními KV rizikovými faktory u pacientů s hypertenzí a vysokou prevalencí DM. Do studie bylo zařazeno celkem 2429 pacientů rozdělených do 4 kvartilů podle výše urikémie. Prevalence MetS, CKD a KV příhod byla v této skupině pacientů 72 %, 43 % a 20 %. Výše hladiny kyseliny močové pozitivně korelovala s přítomností MetS a jeho komponent, přítomností CKD a horším KV profilem. Po odstranění vlivu komponent MetS přetrvávala významná korelace mezi sérovou hladinou kyseliny močové, výskytem KV příhod a hodnotou Framinghamského rizikového skóre. Tato asociace byla silnější u jedinců bez DM a CKD. Hyperurikémie tedy představovala významný nezávislý rizikový faktor vývoje MetS a KV onemocnění v populaci pacientů léčených pro hypertenzi.
Jednoznačně bylo potvrzeno, že hyperurikémie představuje rizikový faktor pro rozvoj DM2. Například v roce 2013 byl publikován článek, který se zabýval vztahem mezi hyperurikémií a vývojem DM 2. typu v populaci amerických veteránů. Roční incidence diabetu byla 19 % v populaci s urikémií ≤ 420 µmol/l, 23 % s urikémií > 420 µmol/l a ≤ 540 µmol/l a 27 % s urikémií > 540 µmol/l (P < 0,001). Hyperurikémie byla spojena s významně vyšším rizikem vývoje diabetu i po odstranění vlivu další rizikových faktorů. Přibližně 8,7 % nových případů diabetu bylo spojeno s přítomností hyperurikémie. Jinými slovy 1 z 11 nových případů DM2 byl přisuzován hyperurikémii.
Některé studie prokázaly korelaci mezi sérovou hladinou kyseliny močové a rizikem vývoje diabetické nefropatie. U 1463 pacientů s DM2, kteří byli rozděleni do několika skupin podle výše urikémie, byla pozorována významně vyšší prevalence MetS, centrální obezity, hypertenze, hypertriglyceridémie, CKD a makroalbuminurie u pacientů zařazených do podskupiny s nejvyšší urikémií.
I samotná asymptomatická hyperurikémie představuje nezávislý rizikový faktor celkové i KV mortality
Zajímavá data poskytl opět NHANES III. Průzkum potvrdil u pacientů s dnou zvýšení rizika celkové mortality o 42 % a KV mortality o 58 %. Analýza dat dále prokázala, že každé zvýšení urikémie o 60 µmol/l zvyšuje celkovou i KV mortalitu o 16 %. Po rozdělení souboru jedinců bez manifestní dny do čtyř kvartilů podle výše urikémie byla celková i KV mortalita u osob zařazených do 2 nejvyšších kvartilů, ve srovnání s osobami zařazenými do nejnižšího kvartilu, zvýšena o 9 %, respektive 37 %. Mnohé práce naopak potvrzují zvýšenou prevalenci hyperurikémie u pacientů s chorobami, které jsou součástí MetS. Bylo prokázáno, že hyperurikémie je častěji přítomna u jedinců se zvýšeným KV rizikem, tedy obecně u mužů, postmenopauzálních žen, obézních, u hypertoniků zejména s orgánovými komplikacemi, u pacientů s DM2 a dyslipidémií. U jedinců s hypertenzí a současně s MetS byla prokázána přímá korelace mezi sérovou hladinou kyseliny močové a hodnotou BMI, lačnou glykémií a indexem inzulinové rezistence HOMA-IR.
Inzulinová rezistence manifestující se hyperinzulinémií snižuje vylučování kyseliny močové ledvinami v proximálním tubulu a přispívá k rozvoji hyperurikémie. Ledvinné tubuly jsou hlavní cestou clearence kyseliny močové. Studie NHANES poskytla data týkající se vzájemného vztahu mezi snížením glomerulární filtrace, hyperurikémií a dnou. Ukázalo se, že pokles glomerulární filtrace je významným rizikovým faktorem pro rozvoj hyperurikémie a dny. Ale vztah mezi glomerulární filtrací a hyperurikémií a dnou není lineární a hranice, od které lze předpokládat dramatické zvýšení prevalence dny, je 60 ml/min na 1,73 m2.
Ve studii íránských autorů byl hodnocen vztah mezi sérovou hladinou kyseliny močové a krevním tlakem u 60 pacientů s DM2. Žádný ze zařazených pacientů neměl dnu a nebyl před zařazením do sledování léčen léky snižujícími hladinu kyseliny močové ani antihypertenzivy. Práce prokázala významnou pozitivní korelaci mezi sérovou hladinou kyseliny močové a hodnotami systolického a diastolického krevního tlaku u pacientů s DM2.
Zvýšené riziko hyperurikémie bylo zaznamenáno u hypertoniků, ale i u osob s hraničními hodnotami krevního tlaku, tedy s tzv. prehypertenzí, a současnou mikroalbuminurií (MAU). Jedinci s MAU měli statisticky významně vyšší hladiny kyseliny močové v séru ve srovnání s jedinci bez mikroalbuminurie. Tento vztah nebyl pozorován u normotenzních osob.
Vzájemný vztah hyperurikémie a DM2 lze shrnout do tří následujících bodů :
1. Existuje vztah mezi hyperurikémií, MetS a KV morbiditou a mortalitou.
2. Hyperurikémie predikuje vývoj DM2. Zvýšené sérové hladiny kyseliny močové lze detekovat již v časných stadiích poruchy glukózového metabolismu.
3. Hyperurikémie je u diabetiků spojena s rozvojem mikrovaskulárních a makrovaskulárních komplikací.
Terapie hyperurikémie a dny u pacientů s DM 2. typu a KV riziko
V následujícím textu se budeme snažit hledat odpovědi na následujících několik otázek:
Jaká je nejvhodnější léčba symptomatické hyperurikémie u pacientů s DM 2. typu? Dokáže léčba symptomatické hyperurikémie snížit riziko vývoje makrovaskulárních komplikací diabetu? Dokáže léčba symptomatické hyperurikémie snížit riziko celkové a KV mortality?
Jak již bylo dříve uvedeno, hyperurikémie je nezávislým rizikovým faktorem nejen pro rozvoj samotné dny, ale i DM2, onemocnění ledvin a dalších chorob řazených do MetS. Základním předpokladem léčby pacientů se symptomatickou hyperurikémií je proto snížení sérové hladiny kyseliny močové. Podle doporučení Evropské ligy proti revmatismu (EULAR) a Americké koleje revmatologů (ACR) by léčba měla být vedena tak, aby bylo dosaženo cílové urikémie nižší než 360 μmol/l, s tím, že další pozitivní efekt může přinést snížení urikémie až pod hodnotu 300 μmol/l.
K léčbě hyperurikémie a dny se používají zejména léky ze skupiny inhibitorů enzymu XO alopurinol a nově febuxostat. Urikosurika probenecid a benzbromaron nejsou v ČR registrována.
Alopurinol je používán k léčbě hyperurikémie již od roku 1965. Je to purinový inhibitor XO, který inhibuje redukovanou formu tohoto enzymu. Alopurinol a jeho metabolit je z 80 % vylučován glomerulární filtrací ledvinami.
U pacientů s renální insuficiencí by měla být dávka snížena a při clearance pod 20 ml/min by neměla přesahovat 100 mg denně, což značně omezuje jeho terapeutické použití a snižuje pravděpodobnost dosažení cílové urikémie.
V roce 2012 byl na český trh uveden nový, silný, selektivní inhibitor XO febuxostat. Terapeutickou indikací pro febuxostat je hyperurikémie s depozity. Febuxostat inhibuje jak oxidované, tak redukované formy enzymu XO. Clearence febuxostatu je zajištována játry i ledvinami. Farmakokinetika febuxostatu není významně ovlivněna poklesem ledvinných funkcí (mírná porucha funkce – GFR: 50–80 ml/min/1,73 m2 nebo středně těžká porucha funkce GFR: 30–50 ml/min/1,73 m2) nebo jaterních funkcí (mírná porucha – Child-Pugh skóre A; nebo středně těžká porucha jaterních funkcí – Child-Pugh skóre B).
Doporučená dávka je 80 mg 1x denně s možností zvýšení na 120 mg 1x denně, pokud není dosaženo cílových hodnot urikémie (360 µmol/l). U pacientů s mírnou nebo středně těžkou poruchou funkce ledvin není nutná žádná úprava dávkování. Účinnost a bezpečnost nebyla plně hodnocena u pacientů s těžkou poruchou funkce ledvin (clearance kreatininu < 30 ml/min). Doporučené dávkování u pacientů s mírnou poruchou funkce jater je 80 mg 1x denně. U pacientů se středně těžkou poruchou funkce jater jsou k dispozici omezené informace. Účinnost a bezpečnost febuxostatu nebyla hodnocena u pacientů s těžkou poruchou funkce jater (Child-Pugh skóre C). Žádná úprava dávkování není nutná také u starších pacientů. Febuxostat může předepsat každý lékař při dodržení podmínek úhrady stanovených Státním ústavem pro kontrolu léčiv.
V rozsáhlém klinickém výzkumu na pacientech s dnou (N = 3189) byla prokázána významně vyšší účinnost febuxostatu 80 mg a 120 mg denně ve srovnání s alopurinolem 300 mg a 100 mg denně ve snížení sérové hladiny kyseliny močové pod doporučovaných 360 μmol/l. Dlouhodobá léčba febuxostatem vede k redukci počtu dnavých záchvatů a k redukci velikosti a počtu dnavých tofů.
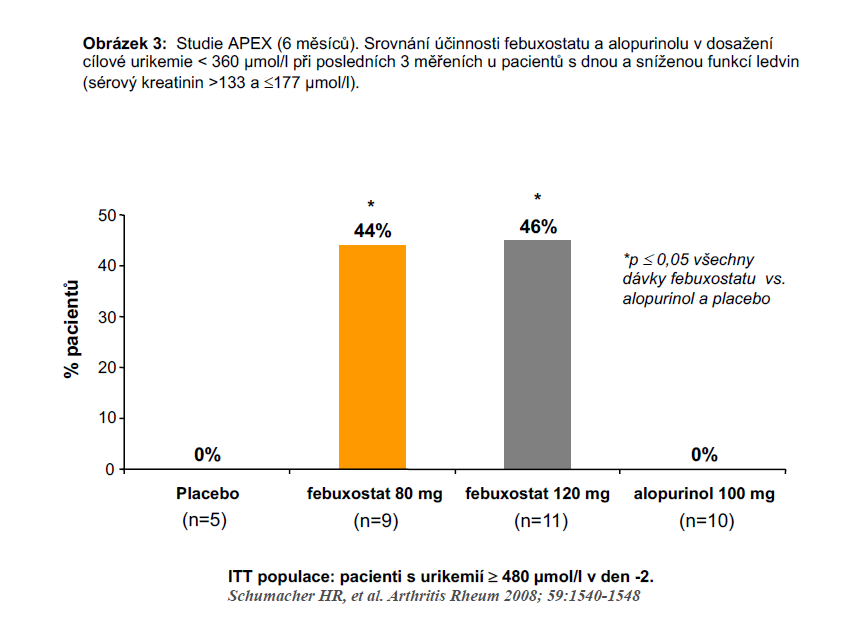
V randomizované, dvojitě zaslepené, multicentrické, 28týdenní studii fáze 3 APEX měla část pacientů s dnou (n = 40) zařazených do sledování také sníženou renální funkci definovanou hodnotou sérového kreatininu > 133 a ≤ 177 µmol/l. Cílové urikémie < 360 µmol/l bylo dosaženo u 44 % těchto pacientů léčených febuxostatem 80 mg 1x denně a u 46 % pacientů léčených febuxostatem 120 mg 1x denně, ale ani u jednoho pacienta léčeného alopurinolem nebo placebem (obrázek 3).
Léčbu febuxostatem není zatím doporučeno zahajovat u pacientů s ischemickou chorobou srdeční nebo městnavým srdečním selháním. Důvodem byl vyšší výskyt KV příhod ve studiích APEX a FACT. Výsledky těchto studií měla potvrdit nebo vyvrátit studie CONFIRMS, která zmíněné KV riziko nepotvrdila. Studie neprokázala statisticky významné rozdíly mezi febuxostatem a alopurinolem ani příčinnou souvislost mezi zvýšeným výskytem KV příhod a léčbou febuxostatem.
Přesto bylo zmíněné doporučení zatím ponecháno v platnosti. V současné době probíha prospektivní, randomizovaná, otevřená studie FAST srovnávající KV bezpečnost léčby febuxostatem a alopurinolem u pacientů se symtomatickou hyperurikémií. Její výsledky se v brzké době očekávají.
Alopurinol je podle výsledků některých prací schopen redukovat oxidační stres, zlepšovat endoteliální funkce, potlačovat zánětlivý stav a předcházet rozvoji aterosklerózy. Jiná práce však tyto výsledky nepotvrdila.
V odborné literatuře se v posledních letech objevují velice nadějná data, prokazující pozitivní vliv febuxostatu na snížení oxidačního stresu, zánětlivého stavu, endoteliální dysfunkce nebo prevenci progrese ledvinného postižení u osob bez diabetu i s DM 2. typu. Uveďme tedy několik příkladů.
V recentní prospektivní studii byli sledováni nově diagnostikovaní pacienti s dnou starší 40 roků, bez přítomného KV onemocnění. Pacienti byly rozděleni na dva podsoubory zahrnující stejný počty pacientů léčených alopurinolem a bez léčby alopurinolem. Obě kohorty se nelišily v parametrech věku, pohlaví, výskytu DM, hypertenze, dyslipidémie a fibrilace síní. Primární výsledek studie: Terapie alopurinolem u pacientů s dnou nevedla ke zlepšení KV parametrů.
Riziko vývoje KV příhod bylo v průběhu sledování (medián 5,25 roků) dokonce mírně vyšší ve skupině léčené alopurinolem než ve skupině neužívající tento lék (HR 1,25; 95% CI 1,10 – 1,41). Pacienti léčení urikosuriky měli mírně nižší KV riziko ve srovnání s pacienty léčenými alopurinolem (HR 0,83; 95% CI 0,73–0,95).
V loňském roce byly zveřejněny výsledky menší prospektivní studie, která srovnávala vliv 12měsíční léčby alopurinolem a febuxostatem na parametry oxidačního stresu a vaskulární funkce u pacientů s chronickou dnou. Před vstupem do hodnocení byla u všech pacientů optimalizována léčba hypertenze, dyslipidémie a DM a tato léčba nebyla v jeho průběhu měněna. 12měsíční léčbu dokončilo 17 z 19 pacientů, 9 z nich bylo léčeno alopurionolem a 8 febuxostatem. Primární cíle studie zahrnovaly sledování sérové hladiny kyseliny močové a laboratorních parametrů zánětu (CRP, TNFα). K sekundárním cílům patřilo monitorování oxidačního stresu a endoteliální dysfunkce pomocí měření rychlosti pulsové vlny (carotid-femoral pulse wave velocity – cfPWV). Léčba byla vedená s cílem dosáhnout cílové urikémie < 360 μmol/l. U pacientů se sníženou funkcí ledvin byla přednostně zahajována léčba febuxostatem, protože se předpokládala nutnost zvyšovat dávku alopurinolu nad 300 mg denně.
V obou skupinách bylo dosaženo významného snížení urikémie, počtu dnavých záchvatů a redukce velikosti sledovaného dnavého tofu. Hodnoty CRP se v obou skupinách v průběhu léčby významně neměnily. Iniciálně vyšší hladiny TNFα významně klesaly v průběhu studie pouze u pacientů léčených febuxostatem. U všech pacientů docházelo k poklesu aktivity NADPH oxidázy (NOX), ale pouze u jedinců léčených febuxostatem byl pokles signifikantní. Při sledování vaskulárních funkcí pomocí cfPWV došlo k signifikantnímu zhoršení tohoto parametru pouze ve skupině léčeně alopurinolem, zatímco ve skupině léčené febuxostatem se hodnoty cfPWV neměnily. Studie potvrdila, že léčba alopurinolem a febuxostatem je účinná ve snížení sérové hladiny kyseliny močové, redukci počtu dnavých záchvatů a velikosti dnavých tofů, ale febuxostat navíc redukoval některé parametry zánětu a dokázal účinně předcházet progresi endoteliální dysfunkce.
Febuxostat na zvířecím modelu snižoval riziko vývoje diabetické nefropatie. Ke studiu byly použity krysy se streptozotocinem indukovaným diabetem. Albuminurie významně klesala u zvířat léčených febuxostatem v porovnání s neléčenými krysami. Diabetické krysy měly v porovnání se zdravými krysami vyšší aktivitu XO a její aktivita významně klesala při léčbě febuxostatem. Terapie febuxostatem rovněž vedla ke snížení parametrů oxidačního stresu a zánětu.
Stejná pracovní skupina publikovala své poznatky týkající se zlepšení parametrů endoteliální dysfunkce po léčbě febuxostatem na totožném zvířecím modelu.
V roce 2013 byla zveřejněna analýza 6měsíční randomizované, kontrolované studie, která srovnávala léčbu febuxostatem a alopurinolem u pacientů s dnou s nebo bez diabetu. Pacienti s dnou a diabetem byli starší, častěji ženy, a měli delší trvání choroby. V této skupině byl rovněž častěji pozorován výskyt KV onemocnění, CKD, dyslipidémie a obezity. Febuxostat byl ve srovnání s alopurinolem účinnější v dosažení cílové urikémie ≤ 360 μmol/l nezávisle na funkci ledvin.
Řada prací prokázala rovněž renoprotektivní efekt febuxostatu. V roce 2013 byla publikována analýza dat ze studie EXCEL. Do této dlouhodobé otevřené studie, která sledovala dlouhodobou účinnost a bezpečnost léčby febuxostatem nebo alopurinolem, přecházeli pacienti s hyperurikémií a dnou, původně zařazení do dvou velkých klinických hodnocení 3. fáze (APEX, FACT). Kohortu tvořilo celkem 1086 pacientů léčených iniciálně febuxostatem 80 mg nebo 120 mg denně nebo alopurinolem 300 mg denně. Léčba mohla být upravována tak, aby se cílová urikémie pohybovala v rozpětí ≥ 180 a < 360 μmol/l. Pro hodnocení bylo vybráno 551 pacientů, kteří byli v průběhu celé studie (≤ 48 měsíců) léčeni pouze febuxostatem. Analýza prokázala pozitivní vliv léčby febuxostatem na ochranu ledvinných funkcí. Každé dlouhodobé snížení sérové hladiny kyseliny močové o 60 μmol/l u pacientů s dnou bylo spojeno s udržením glomerulární filtrace vyšší o 1,15 ml/min.
Na konci loňského roku byly publikovány výsledky roční prospektivní studie, která hodnotila vliv léčby febuxostatem na ochranu ledvinných funkcí u pacientů s hyperurikémií a CKD (odhadovaná glomerulární filtrace < 45 ml/min). U 51 pacientů byl alopurinol nahrazen febuxostatem a u 22 pacientů léčba alopurinolem pokračovala. K významnému poklesu urikémie došlo pouze ve skupině léčené febuxostatem, zatím co ve skupině léčené alopurinolem došlo naopak k nárůstu hladiny kyseliny močové. Febuxostat navíc významně zpomaloval progresi renálního postižení.
Lze tedy konstatovat, že inhibitory enzymu XO alopurinol a zejména febuxostat jsou vhodnými léky určenými k léčbě symptomatické hyperurikémie u pacientů s i bez komorbidit včetně DM. U diabetiků s mírně (GFR: 50–80 ml/min) až středně sníženou funkcí ledvin (GFR: 30–50 ml/min) nemusí být denní dávka febuxostatu redukována, zatím co denní dávka alopurinolu by měla být snížena. Nejsou informace o tom, že by u pacientů s těžkou poruchou funkce ledvin (GFR: pod 30 ml/min) bylo nutné dávku febuxostatu 80 mg redukovat.
Febuxostat je rovněž účinnější v dosažení cílové urikémie u pacientů s CKD a výhodný je i jeho renoprotektivní efekt. Data týkající se efektu alopurinolu na snížení oxidačního stresu, endoteliální dysfunkce a KV rizika jsou nekonzistentní.
U febuxostatu naopak některé studie prokazují pozitivní efekt na snížení oxidačního stresu, zánětlivého stavu, endoteliální dysfunkce nebo prevenci progrese ledvinného postižení u osob s DM 2. typu nebo bez DM2.
Díky zvýšenému výskytu některých KV příhod v klinických studiích III. fáze s febuxostatem není v současné době jeho použití doporučeno u pacientů s ischemickou chorobou srdeční nebo městnavým srdečním selháním. Netrpělivě jsou proto očekávány výsledky studie FAST, která si klade za cíl srovnat KV bezpečnost léčby febuxostatem a alopurinolem u pacientů se symtomatickou hyperurikémií.
Prevalence hyperurikémie, dny a DM 2. typu v posledních letech významně narůstá. Zvýšené sérové hladiny kyseliny močové lze detekovat již v časných stadiích poruchy glukózového metabolismu. Hyperurikémie je nejvýznamnějším ovlivnitelným rizikovým faktorem vývoje dny, ale představuje rovněž významné riziko pro rozvoj KV onemocnění, DM 2. typu a onemocnění ledvin a je rovněž nezávislým rizikovým faktorem celkové a KV mortality. Inzulinová rezistence a s ní spojená hyperinzulinémie je významným rizikovým faktorem vývoje MetS, který je charakterizován přítomností poruchy metabolismu glukózy, centrálního typu obezity, hypertentze, aterogenní dyslipidémie a rovněž hyperurikémie a protrombotického stavu. Mezi těmito chorobami a metabolickými odchylkami existuje řada na sobě závislých vazeb, které vedou ke zvýšení jejich incidence a přispívají i ke zvýšení celkové a KV mortality. Léčba hyperurikémie vede nejen k potlačení symptomů dny, ale může rovněž přispět ke snížení rizika vývoje přidružených onemocnění a ke snížení celkové a KV mortality. Mnohá data naznačují, že febuxostat je schopen účinně potlačovat oxidační stres a zánět, zpomalovat progresi endoteliální dysfunkce nebo pokles ledvinných funkcí u osob s i bez DM2. Proto by febuxostat mohl být vhodným lékem pro léčbu symptomatické hyperurikémie také u diabetiků 2. typu.
doc. MUDr. Petr Němec, Ph.D.,
Revmatologická ambulance II. interní kliniky
FN u sv. Anny v Brně a LF MU
Autor v souvislosti s tématem článku v minulosti
spolupracoval s farmaceutickou firmou Berlin-Chemie Menarini Group
Tento článek vč. odkazů na literaturu viz www.zezdravotnictvi.cz
Literatura
1. Pavelka K.
DOPORUČENÍ ČESKÉ REVMATOLOGICKÉ SPOLEČNOSTI PRO LÉČBU DNAVÉ ARTRITIDY
Čes. Revmatol., 20, 2012, No. 2, p. 82-92.
2. Karen I. et al
Diabetes mellitus_Doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře.
Společnost všeobecného lékařství ČLS JEP_Centrum doporučených postupů pro praktické lékaře 2005
3. Karns R et al.
Modeling metabolic syndrome through structural equations
Obesity (Silver Spring). 2013 Dec;21(12):E745-54
4. Pavelka K. Dna (arthritis urica). Pavelka K, Rovenský J, et al. Klinická revmatologie.
Galen 2003:347-58.
5. Campion EW, Glynn RJ, DeLabry LO.
Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study.
Am J Med 1987;82(3):421-6.
6. Johnson RJ, Kang DH, Feig D, et al.
Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease?
Hypertension 2003;41(6):1183–90.
7. Adapted by : Neogi T, George J, Rekhraj S et al.
Are Either or Both Hyperuricemia and Xanthine Oxidase Directly Toxic to the Vasculature? A critical appraisal.
Arthritis Rheum. 2012 Feb; 64(2): 327–338
8. Zhang W, Doherty M, Pascual E, et al.
EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT).
Ann Rheum Dis 2006;65(10):1301-11.
9.Mikuls TR, Farrar JT, Bilker WB, et al.
Gout epidemiology: results from the UK General Practice Research Database, 1990-1999.
Ann Rheum Dis 2005;64(2):267-72.
10. Annemans L, Spaepen E, Gaskin M, et al.
Gout in the UK and Germany: prevalence, comorbidities and management in general practice 2000-2005.
Ann Rheum Dis 2008;67(7):960-6.
11. Alamanos Y, Drosos AA.
Epidemiology of adult rheumatoid arthritis.
Autoimmun Rev 2005;4(3):130-6.
12. Grassi D, Ferri L, Desideri G, et al.
Chronic hyperuricemia, uric acid deposit and cardiovascular risk.
Curr Pharm Des 2013;19(13):2432-8.
13. Němec Petr
Hyperurikémie a dna u pacientů s DM 2. typu.
Diabetology news, 2015, roč. 6, č. 2, s. 4-9.
14. Sukhija, R., Aronow, Ws., Kakar, P., et al.
Relation of microalbuminuria and coronary artery disease in patients with and without diabetes mellitus.
The American Journal of Cardiology 2006;98(3):279–281.
15. Choi HK, Ford ES, Li C, Curhan G.
Prevalence of the metabolic syndrome in patients with gout: the Third National Health and Nutrition Examination Survey (NHANES). Arthritis Rheum 2007;57(1):109-15.
16. Viazzi F, Garneri D, Leoncini G et al.
Serum uric acid and its relationship with metabolic syndrome and cardiovascular risk profile in patients with hypertension: insights from the I-DEMAND study.
Nutr Metab Cardiovasc Dis. 2014;24(8):921-7.
17. Krishnan E, Akhras KS, Sharma H, et al.
Relative and attributable diabetes risk associated with hyperuricemia in US veterans with gout.
QJM. 2013;106(8):721-9.
18. Sheikhbahaei S, Fotouhi A, Hafezi-Nejad N, et al.
Metab Syndr Relat Disord. 2014 Mar;12(2):102-9.
Independent impact of gout on mortality and risk for coronary heart disease.
Circulation 2007;116(8):894-900.
20. Stack AG, Hanley A, Casserly LF, et al.
Independent and conjoint associations of gout and hyperuricaemia with total and cardiovascular mortality.
QJM. 2013;106(7):647-58.
21. Facchini F, Chen YD, Hollenbeck CB, Reaven GM.
Relationship between resistance to insulin- mediated glucose uptake, urinary uric acid clearance, and plasma uric acid concentration.
JAMA 1991; 266(21): 3008–11.
22. Krishnan E.
Reduced glomerular function and prevalence of gout: NHANES 2009-10.
PLoS One. 2012;7(11): e50046.
23. Rafieian-Kopaei M, Behradmanesh S, Kheiri S at al.
Association of serum uirc acid with level of blood pressure in type 2 diabetic patients.
Iran J Kidney Dis 2014;8(2):152-4.
24. Lee JAE, Kim YG, Choi YH, Huh W, Kim DJ, Oh HY.
Serum uric acid is associated with microalbuminuria in prehypertension.
Hypertension 2006;47:962–7.
25. Katsiki N, Papanas N, Fonseca VA, et al.
Uric acid and diabetes: Is there a link?
Curr Pharm Des. 2013;19(27):4930-7. Review.
26. Khanna D, Fitzgerald JD, Khanna PP, et al.
2012 American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia.
Arthritis Care Res (Hoboken) 2012;64(10):1431-46.
27. Khanna D, Khanna PP, Fitzgerald JD, et al.
2012 American College of Rheumatology guidelines for management of gout. Part 2: therapy and antiinflammatory prophylaxis of acute gouty arthritis.
Arthritis Care Res (Hoboken) 2012;64(10):1447-61.
28. Pavelka K.
Doporučení České revmatologické společnosti pro léčbu dnavé artritidy.
Čes. Revmatol 2012;20(2):82-92.
29. Databáze registrovaných léčiv sukl.cz staženo dne 10. 8. 2015
30. Pavelka K. Terapie dny. In Pavelka K, et al.
Farmakoterapie revmatických onemocnění.
Grada Publishing 2005:345-51.
31. SPC přípravku Milurit, datum poslední revize 18.9.2013
32. Schumacher HR Jr et al.
Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial (APEX study).
Arthritis Rheum 2008;59(11):1540-8.
33. Okamoto K Nishino T.
Crystal structures of mammalian xanthine oxidoreductase bound with various inhibitors: allopurinol, febuxostat, and FYX-051.
J Nippon Med Sch 2008;75:2-3.
34. Khosravan R, Kukulka MJ, Wu JT, et al.
The effect of age and gender on pharmacokinetics, pharmacodynamics, and safety of febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase.
J Clin Pharmacol 2008;48:1014-1024.
35. SPC přípravku Xados, datum poslední revize 3.1.2012
36. SPC přípravku Adenuric® 80 mg, poslední revize 19. 5. 2015.
37. Rozhodnutí SÚKL v s. ř. SÚKL S203438/2012, v právní moci od 13. 2. 2013.
38. Becker MA, Schumacher HR Jr, Wortmann RL, et al.
Febuxostat compared with allopurinol in patients with hyperuricemia and gout (FACT study).
N Engl J Med 2005; 353:2450-2461.
39. Becker MA, Schumacher HR, MacDonald PA, et al.
Clinical efficacy and safety of successful long term urate lowering with febuxostat or allopurinol in subjects with gout (EXCEL study).
J Rheumatol 2009;36:1273-1282.
40. Schumacher HR Jr, Becker MA, Lloyd E, et al.
Febuxostat in the treatment of gout: 5-year findings of the FOCUS efficacy and safety study.
Rheumatology 2009;48:188-194.
41. Becker MA, Schumacher HR Jr, Wortmann RL, et al.
Febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase: a twenty-eight-day, multicenter, phase II, randomized, double-blind, placebo-controlled, doseresponse clinical trial examining safety and efficacy in patients with gout.
Arthritis Rheum 2005;52:916-923.
42. Becker MA et al.
The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial.
Arthritis Res Ther. 2010;12(2):R63.
43. MacDonald TM, Ford I, Nuki G, et al.
Protocol of the Febuxostat versus Allopurinol Streamlined Trial (FAST): a large prospective, randomised, open, blinded endpoint study comparing the cardiovascular safety of allopurinol and febuxostat in the management of symptomatic hyperuricaemia.
BMJ Open. 2014;4(7):e005354.
44. George J et al.
High-dose allopurinol improves endothelial function by profoundly reducing vascular oxidative stress and not by lowering uric acid.
Circulation 2006; 114: 2508–2516.
45. Kanbay M, Siriopol D, Nistor I, et al.
Effects of allopurinol on endothelial dysfunction: a meta-analysis.
Am J Nephrol 2014; 39(4): 348-56.
46. Kok VC, Horng JT, Chang WS, et al.
Allopurinol therapy in gout patients does not associate with beneficial cardiovascular outcomes: a population-based matched-cohort study.
PLoS One 2014; 9(6): e99102.
47. Tausche AK, Christoph M, Forkmann M, et al.
As compared to allopurinol, urate-lowering therapy with febuxostat has superior effects on oxidative stress and pulse wave velocity in patients with severe chronic tophaceous gout.
Rheumatol Int 2014;34(1):101-9.
48. Lee HJ, Jeong KH, Kim YG, et al.
Febuxostat ameliorates diabetic renal injury in a streptozotocin-induced diabetic rat model.
Am J Nephrol. 2014;40(1):56-63.
49. Hwang SJ, Lee KH, Jang HH, et al.
Int J Cardiol. 2014;171(3):e110-2.
50. Becker MA, MacDonald PA, Hunt BJ, et al.
Diabetes and gout: efficacy and safety of febuxostat and allopurinol.
(Diabetes Obes Metab. 2013;15(11):1049-55.
51. Whelton A, MacDonald PA, Chefo S, et al.
Preservation of renal function during gout treatment with febuxostat: a quantitative study.
Postgrad Med. 2013;125(1):106-14.
52. Tsuruta Y, Mochizuki T, Moriyama T, et al.
Clin Rheumatol. 2014 Nov;33(11):1643-8.
53. Sezai A et al.
J Cardiol. 2015 Oct;66(4):298-303.
54.Sezai A et al.
Circ J. 2013;77(8):2043-9.
55. Fukui T et al.
Effects of Febuxostat on Oxidative Stress.
Clin Ther. 2015 Jul 1;37(7):1396-401.
56.Tausche AK et al.
Rheumatol Int. 2014 Jan;34(1):101-9.
57. Tsuda H et al.
Febuxostat suppressed renal ischemia-reperfusion injury via reduced oxidative stress.
Biochem Biophys Res Commun. 2012 Oct 19;427(2):266-72.
