Roztroušená skleróza i neuromyelitis optica a onemocnění jejího širšího spektra patří mezi demyelinizační onemocnění centrálního nervového systému. Jejich patogeneze i léčba jsou odlišné. Společný však mají prudký rozvoj terapeutických možností v posledních letech měnící zásadním způsobem průběh nemoci.
Roztroušená skleróza
Roztroušená skleróza (RS) je nejčastějším zástupcem demyelinizačních chorob. V České republice tímto onemocněním trpí přibližně 20–25 tisíc osob. V patogenezi a výsledném individuálním klinickém obraze tohoto chronického onemocnění centrálního nervového systému (CNS) hraje roli řada faktorů: akutní zánětlivé aktivity, chronický „doutnající“ zánět, demyelinizace bílé a šedé hmoty, axonální degenerace, ztráta nervových buněk a remyelinizace.
Cílem zánětu jsou primárně myelinové obaly nervových vláken v bílé i šedé hmotě. Při demyelinizaci dochází k rozvoji akutní neurologické symptomatologie, podkladem trvalého poškození i progrese nezávislé na relapsech je pak ztráta neuronů a nervových vláken. Je přítomna vedle zánětlivé složky již od počátku nemoci a postupně začíná dominovat. Komplexní je i etiopatogeneze RS z pohledu jednotlivých složek imunitního systému. Roli v ní hrají vzájemné interakce jak infiltrujících T a B lymfocytů, tak rezidentních buněk CNS, zejména mikroglií a astrocytů.
RS je tedy onemocnění v čase i interindividuálně značně variabilní. Z praktických důvodů, zahrnujících i indikační kritéria léčby, je však snaha rozdělit RS pouze na několik základních fenotypů. Nejznámější klasifikace podle Lublina z roku 1996 rozděluje onemocnění na relaps-remitentní (80–85 %), sekundárně progresivní (navazující na relaps-remitentní), primárně progresivní (10–15 %) a progredující relabující formu (jednotky procent). Poslední aktualizace této klasifikace z roku 2013 částečně zohledňuje poznatky o přítomnosti zánětlivé i progresivní složky již od počátku nemoci. Na základě zastoupení těchto procesů dělí RS na relabující a progresivní a oba fenotypy pak na aktivní nebo neaktivní (podle nálezu na magnetické rezonanci či přítomnosti relapsů).
Dlouhodobá léčba relabující RS
Začátky účinné léčby RS lze datovat do šedesátých let 20. století, kdy bylo zjištěno, že kortikoidy vedou k rychlejší úpravě stavu při akutních atakách. Další zlom nastal v roce 1993, kdy se na trh dostal první chorobu modifikující lék (DMD – disease modifying drug/„biologická léčba“) – interferon beta. Od té doby se léčebná paleta stále rozšiřuje. V současnosti máme pro pacienty s relabující RS k dispozici více než desítku DMD s různými mechanizmy účinku (tabulka 1). Jejich cílem je minimalizovat zánětlivou aktivitu v CNS, tedy v ideálním případě zamezit výskytu/omezit závažnost relapsů, zabránit aktivitě pozorované na magnetické rezonanci a co nejvíce omezit progresi a zhoršování neurologického deficitu.
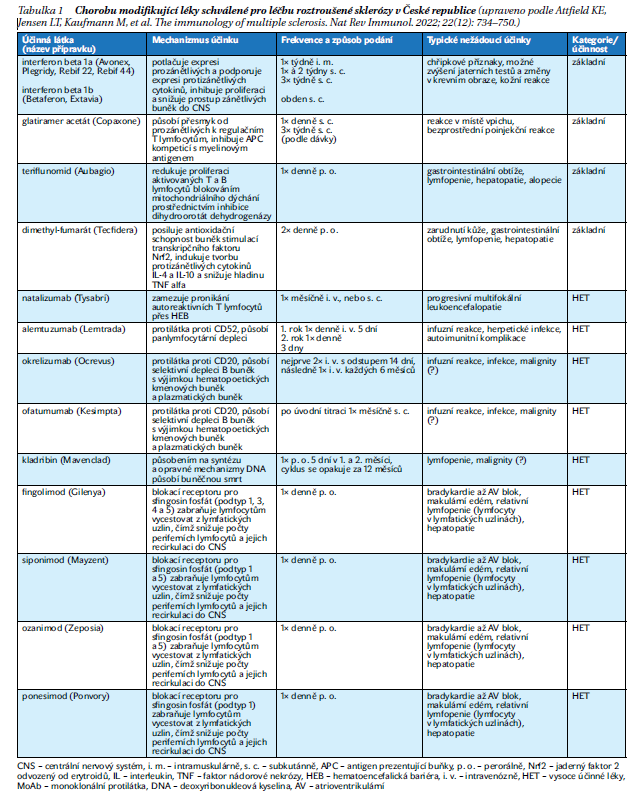
Na základě účinnosti doložené v klinických studiích dělíme DMD na léky základní (platform) s obecně nižší účinností, ale lepším bezpečnostním profilem, a vysoce účinné (HET – high efficacy treatment). Toto dělení je nicméně do značné míry arteficiální. Vzhledem k odlišnému mechanizmu účinku a variabilitě nemoci však může konkrétnímu pacientovi posloužit základní lék lépe než lék ze skupiny HET.
Kromě konkrétního typu DMD je klíčové i načasování terapie a vzájemná posloupnost léčby. Jednoznačně platí, že čím dříve je léčba zahájena, tím větší je její efekt a menší míra postižení v čase. V současnosti dostupné DMD totiž ovlivňují pouze zánětlivou složku, která je dominantní v počátečních fázích nemoci. Terapie schopná snížit nebo zvrátit postižení pomocí opravných mechanizmů včetně remyelinizace, axonálního pučení nebo neurogeneze je zatím bohužel pouze nedosaženým ideálem. Co se sekvence podávání DMD týče, obecně jsou nasazovány v rámci dvou základních terapeutických strategií. U tzv. eskalační strategie jsou zpočátku nasazovány základní DMD (interferon beta, glatiramer acetát, teriflunomid a dimethyl-fumarát) a teprve při nedostatečné účinnosti je léčba eskalována na HET.
Druhou variantou je časná intenzivní strategie s nasazením HET (S1P modulátory, DMD cílící na molekulu CD20, natalizumab, alemtuzumab, kladribin) již od počátku nemoci. Data z klinických studií i z reálné klinické praxe stále více ukazují, že použití vysoce účinné protizánětlivé terapie hned v úvodu přináší lepší klinický benefit. Je ale třeba mít na paměti i horší bezpečnostní profil HET ve srovnání s DMD základními. Dalším omezením jsou pak úhradová kritéria, která jsou zpravidla striktnější než kritéria stanovaná Evropskou lékovou agenturou. Trend je však příznivý a v současnosti lze již v souladu s úhradovými kritérii v České republice nasadit za splnění určitých podmínek po první atace RS tři DMD ze skupiny HET (okrelizumab, ofatumumab, ponesimod).
Dlouhodobá léčba progresivní RS
Vzhledem k tomu, že u progresivní RS převládá neurodegenerace nad zánětem, proti kterému jsou DMD namířena, většina DMD využívaných u relabující formy se u progresivní RS neosvědčila. I u progresivní RS je však nepochybně přítomna zánětlivá složka a podaří-li se zánět zpomalit, dochází pravděpodobně i ke zpomalení procesu neurodegenerace.
S DMD se prvně dostalo na pacienty s primárně progresivní RS. V roce 2018 byl schválen k léčbě tohoto fenotypu okrelizumab. Schválení prvního DMD pro dospělé pacienty se sekundárně progresivní RS – siponimodu – v České republice proběhlo v roce 2021 (tabulka 1). Mimo tyto již registrované preparáty je v různých fázích klinického zkoušení celá řada dalších látek. Mezi nejnadějnějšími lze zmínit inhibitory Brutonovy tyrosinkinázy. Neuroprotektivní léčba plně respektující odlišnou patogenezi progresivních forem RS zatím bohužel stále není k dispozici. Jak u relabující, tak u progresivní RS tak stále zůstává nejefektivnějším postupem pro ovlivnění progrese co nejvčasnější zahájení léčby s potlačením zánětlivé aktivity a také uplatňování komplexního léčebného programu s důrazem na zdravý životní styl se zanecháním kouření, snížením rizika komorbidit, podpůrnou psychoterapií a fyzioterapií.
Neuromyelitis optica a onemocnění jejího širšího spektra
Dalším chronickým autoimunitním demyelinizačním onemocněním je neuromyelitis optica a onemocnění jejího širšího spektra (NMOSD). Odhaduje se, že v Evropě NMOSD tvoří asi 1 % získaných demyelinizačních onemocnění CNS. Naopak u asijské populace je výskyt mnohem vyšší (asi 20– 40 % demyelinizačních onemocnění). Tato autoimunitní astrocytopatie je charakterizována záněty zrakového nervu a míchy, méně často mozkového kmene. Poměrně specifickým příznakem, který může být snadněji opomenut, je dlouhotrvající singultus.
Od RS ji definitivně odlišil objev protilátek proti akvaporinu 4, které jsou pro NMOSD specifické. Jejich průkaz však není podle kritérií pro NMOSD podle Wingerchuka z roku 2015 podmínkou stanovení diagnózy. Dalším zásadním rozdílem je příčina neurologického deficitu. U této choroby je dominantně následkem relapsů onemocnění. Časné stanovení diagnózy, agresivní léčba relapsů vysokými dávkami kortikoidů, často s navazujícím využitím plazmaferézy, a poté okamžité zahájení chronické léčby zamezující rozvoji nebo omezující tíži dalších relapsů je proto zcela klíčové. Odlišení od RS je zásadní i z důvodu rizika dekompenzace stavu a vyvolání relapsu při zahájení léčby většinou DMD využívaných v léčbě RS (zejména interferonem beta, natalizumabem, fingolimodem a alemtuzumabem).
Dlouhodobá léčba NMOSD
Vzhledem k autoimunitní etiologii NMOSD je základem často kombinovaná imunosupresivní léčba(kortikoidy, mykofenolát mofetil, azathioprin, methotrexát atd.). Vzhledem k protilátkové podstatě nemoci má své pevné místo v léčbě NMOSD i monoklonální protilátka cílící na molekulu CD20 na povrchu B lymfocytů – rituximab. U pacientů, kteří na rituximab neodpovídají, je možné za cenu zvýšení rizika komplikací k rituximabu přidat některé z klasických imunosupresiv.
Druhou variantou je nasadit tocilizumab– blokátor receptoru pro interleukin 6. Při vyčerpání terapeutických možností se v některých případech přistupuje i ke chronickému plazmaferetickému programu (většinou jednou týdně) a v ojedinělých případech k transplantaci autologní či heterologní kostní dřeně (tabulka 2).
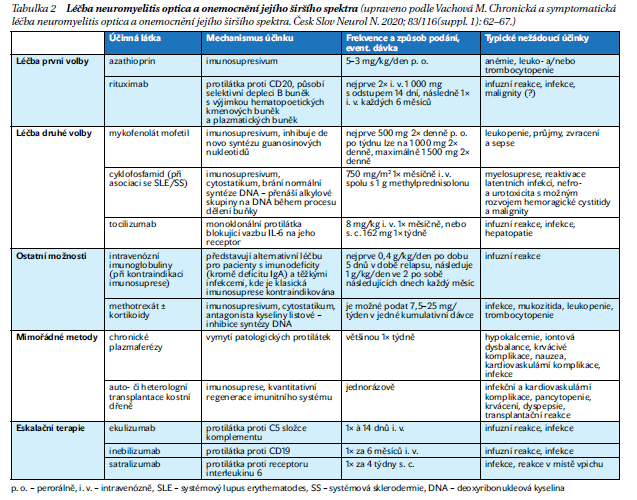
Vývoj nových DMD určených pro pacienty s NMOSD je v posledních letech až závratný. V ojedinělých případech je tak již možno zažádat o využití nejnovějších DMD – protilátky proti C5 složce komplementu – ekulizumabu, protilátky proti molekule CD19 na povrchu lymfocytů – inebilizumabua protilátky proti receptoru IL-6 – satralizumabu. Účinnost těchto tří monoklonálních protilátek na NMOSD byla na rozdíl od dosud využívaných terapeutických metod ověřena klinickými studiemi, na jejichž základě byly k léčbě NMOSD schváleny Evropskou lékovou agenturou. Ekulizumab, inebilizumab a satralizumab jsou tak jedinými léky, které je možno podávat pacientům s NMOSD on‑label. Paradoxně však tyto monoklonální protilátky na rozdíl od výše uvedených léků nejsou zatím hrazeny ze zdravotního pojištění. Probíhají však jednání o úhradě a situace se snad brzy změní k lepšímu.
Jasná terapeutická doporučení chybí pro pacienty s klinickým obrazem NMOSD, u nichž je prokázána pozitivita protilátek proti myelinovému oligodendrocytárnímu glykoproteinu. Část těchto pacientů může mít jen monofázický průběh. Ve většině případů se u dospělých pacientů dlouhodobá léčba doporučuje při přetrvávající pozitivitě těchto protilátek.
Závěr
Jak roztroušená skleróza, tak neuromyelitis optica a onemocnění jejího širšího spektra jsou závažná chronická neurologická onemocnění. Díky významnému pokroku v poznání jejich etiopatogeneze a vývoji nových chorobu modifikujících léků se prognóza dnes diagnostikovaných pacientů významně liší od dob dřívějších. Pro úspěšnost terapie je však zásadní včasná a správná diagnostika a vedení léčby neurologem se zkušenostmi s touto problematikou. Neméně důležitý je komplexní přístup k pacientovi a mezioborová spolupráce cílící na ovlivnění rizikových faktorů, zejména kuřáckého návyku a ovlivnění nepříznivě působících komorbidit, fyzioterapie a psychoterapie.
MUDr. Dominika Šťastná
Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze
