Možnosti léčby renálního karcinomu (RCC – renal cell carcinoma) se vyvíjejí na poli chirurgickém i onkologickém. U chirurgické léčby lokalizovaného onemocnění se přechází k miniinvazivnímu přístupu, a ve vhodných případech i na výkon šetřící ledvinu. U pacientů s pokročilým a metastatickým RCC se s nástupem nových léčiv stala standardem léčba cílená (biologická) a imunoterapie. Prognóza těchto pacientů se výrazně zlepšila. Vzhledem ke stále novým poznatkům a výsledkům studií se bude léčba a prognóza pacientů s RCC nadále vyvíjet.
Česká republika má prvenství v incidenci RCC v porovnání s ostatními zeměmi světa.
Incidence RCC v České republice je v posledních letech stacionární, a to kolem 30 případů na 100 tisíc obyvatel. Pozitivem je nárůst případů zachycených již v I. a II. stadiu onemocnění, tj. nádory omezené na ledvinu, které mají nejlepší prognózu. Jedná se především o náhodné nálezy zjištěné nejčastěji při sonografickém nebo CT vyšetření. Mortalita má v posledních letech spíše klesající trend a pohybuje se kolem 10 případů na 100 tisíc obyvatel. Muži jsou diagnostikováni s renálním karcinomem dvakrát častěji než ženy. Výskyt se pohybuje nejčastěji okolo 60. roku věku.
Léčba lokalizovaného RCC
Mezi lokalizované nádory řadíme onemocnění v I. klinickém stadiu (T1, N0, M0), ve II. klinickém stadiu (T2, N0, M0) a operabilní nádory klinického stadia III (T3, N0, M0 nebo T1 – 3, N1, M0).
Chirurgická léčba
U lokalizovaného RCC je základem radikální chirurgická léčba. U nádorů do velikosti 7 cm (T1), s vhodnou lokalizací, při zachování pravidel dostatečné onkologické radikality, je preferován ledvinu šetřící výkon. V ostatních případech je indikována radikální nefrektomie, tj. odstranění ledviny včetně Gerotovy fascie s přilehlým tukovým polštářem, u nádorů horního pólu ledviny společně s andrenalektomií. U vysoce rizikových tumorů má klinický přínos i provedení lymfadenektomie. Miniinvazivní přístup (laparoskopický nebo robotický) má porovnatelné výsledky proti otevřenému přístupu, a měla by mu být pokud možno dávána přednost vzhledem k nižší morbiditě.
Alternativou chirurgické léčby může být, u malých nádorů pacientů s kratší předpokládanou dobou dožití, minimálně invazivní metoda, například radiofrekvenční ablace.
U pacientů v I. a II. klinickém stadiu onemocnění po radikální chirurgické léčbě převyšuje pětileté přežití 80 %. Postižení lymfatických uzlin ale významně zhoršuje prognózu pacientů.
Systémová léčba
Jednoznačný klinický přínos systémové terapie v adjuvanci nebo neoadjuvanci u lokalizovaného RCC nebyl dosud prokázán, proto její použití mimo klinické studie není standardem.
Léčba generalizovaného RCC
Do této skupiny řadíme neoperabilní lokálně pokročilé nádory (T4, N0 – 1, M0), a dále nádory s přítomností vzdálených metastáz (T1 – 4, N0 – 1, M1).
Chirurgická léčba
Přínosem cytoredukční nefrektomie v porovnání s použitím samotného multikinázového inhibitoru (sunitinibu) se zabývá nedávná prospektivní randomizovaná studie fáze III (CARMENA). Pacienti se světlobuněčným RCC (ve střední nebo špatné prognostické skupině podle MSKCC) byli rozděleni do dvou větví v poměru 1 : 1. V první větvi byl pacientům podán samotný sunitinib, ve druhé větvi byli pacienti s nefrektomií a následným podáním sunitinibu. Cílem bylo celkové přežití (OS – overall survival) pacientů.
Medián OS byl 18,4 měsíců ve větvi se samotným sunitinibem a 13,9 měsíců ve druhé větvi. Podání samotného sunitinibu nemělo proto horší výsledky v porovnání s nefrektomií s následným podáním sunitinibu.
Podle aktualizovaných výsledků studie s použitím stratifikace pomocí IMDC (International Metastatic RCC Database Consortium) by mohli mít přínos z cytoredukční nefrektomie pacienti ve středním riziku pouze s jedním rizikovým faktorem podle IMDC, u nich byl medián přežití 31,4 měsíce ve větvi s chirurgickou léčbou proti 25,2 měsícům se samotným sunitinibem.
Nově též bylo prokázáno, že u pacientů ve větvi se sunitinibem, u nichž byla provedena sekundární nefrektomie, byl medián OS prodloužený v porovnání s pacienty bez nefrektomie (48,5 měsíce vs. 15,7 měsíce).
Indikace cytoredukční nefrektomie a chirurgické odstranění metastáz zůstává nadále přísně individuální, a je vždy potřeba důkladně zvážit přínos operace a operační zátěž pro pacienta.
Paliativní nefrektomie může být indikována v případě konzervativně neřešitelných symptomů, především jinak neřešitelné hematurie. Ke zmírnění příznaků onemocnění se dá využít ale i embolizace renální arterie.
Radioterapie
Radioterapie (RT) má omezený význam v léčbě RCC vzhledem k nízké radiosenzitivitě. Paliativně je možno RT využít u neresekabilních lokálních rekurencí a při metastatickém postižení, zejména kostí nebo mozku.
Nové možnosti může přinést nástup stereotaktické radioterapie (SBRT – Stereotactic Body Radiation Therapy) a radiochirurgie (SRS – Stereotactic Radiosurgery), které umožňují aplikovat do cílového objemu vysokou dávku záření s velkou přesností při minimálním poškození okolních tkání.
Systémová léčba
Chemoterapie
Karcinom ledviny je značně chemorezistentní. Počet léčebných odpovědí je velmi nízký a pohybuje se pro různé režimy chemoterapie do 10 %. Chemoterapii je možno zvážit u pacientů s renálním karcinomem se sarkomatoidní složkou po selhání imunoterapie, režimy jsou v tomto případě shodné s režimy pro léčbu sarkomů měkkých tkání.
Biologická léčba
Nástup biologické léčby dramaticky změnil možnosti terapie pro pacienty s pokročilým renálním karcinomem. Cílená léčba je zaměřená na klíčové dráhy angiogeneze a buněčného metabolismu. Jedná se o signální dráhu vaskulárního endoteliálního růstového faktoru (VEGF – vascular endothelial growth factor), která je klíčová v procesu angiogeneze a její inhibice vede ke zpomalení nebo zastavení růstu nádoru, pro něhož je dostatečné cévní zásobení nezbytné. Mezi inhibiory VEGF patří tyrosinkinázové inhibitory sunitinib, pazopanib, sorafenib, axitinib a monoklonální protilátka proti VEGF bevacizumab. Sunitinib a sorafenib byly jako první cílené léky registrovány v roce 2006. Od té doby přibyla další cílená léčiva, a byla také provedena řada studií, v nichž byly porovnávány účinnost a vhodná sekvence léčby (viz Sekvenční cílená léčba).
Cílená léčba se zaměřuje i na regulační komplex serin-threoninové kinázy, zvaný mammalian target of rapamycin (mTOR). Molekula mTOR se podílí na buněčném růstu, diferenciaci a ovlivňuje tvorbu angiogenních faktorů. Mezi inhibitory molekuly mTOR patří everolimus a temsirolimus. Temsirolimus je podáván intravenózně a je indikován v první linii léčby u pacientů s nesvětlobuněčným RCC; je v ČR hrazen jako lék první volby k léčbě pacientů s pokročilým RCC, kteří mají alespoň tři ze šesti prognosticky závažných rizikových faktorů. Everolimus se podává perorálně a je indikován u pacientů předléčených VEGF-cílenou terapií.
Kabozantinib je dalším z cílených léků, jedná se o perorální multikinázový inhibitor blokující receptory VEGF, MET (receptor pro hepatocytární růstový faktor – HGF) a AXL (receptor pro growth arrest-specific protein 6 – GAS6). Kabozantinib vede nejen k inhibici růstu nádoru, angiogeneze, metastatické progrese nádorového onemocnění, ale také ke snížení lékové rezistence. Kabozantinib se podává perorálně ve formě tablet. V ČR je hrazen ve druhé linii terapie pokročilého světlobuněčného RCC u dospělých pacientů v celkovém funkčním stavu 0 – 1 podle ECOG, kteří už absolvovali terapii tyrosinkinázovým inhibitorem a nevykazují přítomnost symptomatických mozkových metastáz anebo jsou jejich mozkové metastázy patřičně léčené (stabilní a asymptomatické). Tato indikace se opírá o studii METEOR publikovanou v roce 2015, v níž byla hodnocena účinnost kabozantinibu v porovnání s everolimem u pacientů s lokálně pokročilým nebo metastatickým RCC se světlobuněčnou složkou, ve funkčním stavu podle Karnofskyho ≥70 a s progresí při léčbě anti-VEGFR. Studie prokázala statisticky významné zlepšení přežití bez progrese (PFS – progression-free survival) při podání kabozantinibu proti everolimu, bez ohledu na předchozí léčbu. Medián PFS dosáhl 7,4 měsíce při podávání kabozantinibu a 3,8 měsíce při podávání everolimu (HR: 0,58, P <0,001). Medián OS byl rovněž delší při léčbě kabozantinibem – 21,4 měsíce vs. 16,5 měsíce (HR: 0,66, P = 0,0003).
Kabozantinib je nově hrazen i v první linii léčby pokročilého světlobuněčného karcinomu ledviny se střední až špatnou prognózou (s prognostickým skóre podle IMDC o hodnotě 1 – 6) u dospělých pacientů v celkovém stavu 0 – 1 podle ECOG. Indikace se opírá o studii CABOSUN, v níž bylo prokázáno statisticky významné zlepšení PFS při podání kabozantinibu v porovnání se sunitinibem v první linii léčby pokročilého RCC, medián PFS byl 8,2 vs. 5,6 měsíce (HR: 0,66). Kabozantinib byl spojen s významným zlepšením míry léčebné odpovědi (ORR – overall response rate), kompletní nebo částečná odpověď byla dosažena u 36 pacientů (46 %) v porovnání se sunitinibem – 14 pacientů (18 %). Aktualizované údaje z roku 2018 zaměřené na OS, s mediánem sledování 34,5 měsíce, vyšly pro větev s kabozantinibem s mediánem OS 26,6 měsíců, pro větev se sunitinibem s mediánem OS 21,2 měsíců (HR: 0,80). Léčba je hrazena do progrese onemocnění podle platných doporučení RECIST.
Nežádoucí účinky kabozantinibu se ve své četnosti ani typu výrazně neliší od nežádoucích účinků jiných tyrosinkinázových inhibitorů, patří mezi ně průjem, hypertenze, únava, nauzea, snížení chuti k jídlu, syndrom palmoplantární erythrodysestezie (PPES), dysgeusie, zvracení, snížení tělesné hmotnosti, dyspepsie, zácpa, stomatitida, dále zvýšení ALT a AST, anemie, trombocytopenie.
V budoucnu může k léčebnému algoritmu přibýt například i perorální HIF-2α (hypoxia-inducible factor inhibitor), u něhož se předpokládá silný terapeutický potenciál a který je předmětem dalšího zkoumání.
Sekvenční cílená léčba
V klinické praxi se často setkáváme s vytvořením rezistence na léčbu. Proto se jako nejlepší možnost jeví léčba sekvenční. Výběr a pořadí léků se řídí nejen konkrétním pacientem, výsledky studií, histologickým typem nádoru (světlobuněčný versus nesvětlobuněčný karcinom), ale i prognostickým skóre pacienta. Zařazení do prognostické skupiny má dále vliv na možnosti léčby a její úhradu.
Používá se skórovací systém podle Memorial Sloan Kettering Cancer Center (MSKCC) z roku 2002 pro léčbu v první linii cílené terapie multikinázovými inhibitory a bevacizumabem nebo podle International Metastatic Renal Cell Database Consortium (IMDC) z roku 2009 pro léčbu tyrosinkinázovými inhibitory (TKI), a tzv. modifikovaná MSKCC kritéria z roku 2007 pro léčbu temsirolimem.
Prognostické skórovací systémy jsou založeny na hodnocení přítomnosti nebo nepřítomnosti daných faktorů. Podle počtu přítomných pozitivních faktorů se pacient zařazuje do skupiny s dobrou prognózou (žádný faktor), střední (1 nebo 2 faktory) a špatná prognóza (3 a více faktorů).
Pro systém IMDC se jedná o koncentraci hemoglobinu pod dolní hranicí normy, korigovaného sérového kalcia >2,5 mmol/l, Karnofsky index ≤70 % a interval méně než 1 rok od diagnózy do započetí systémové léčby, neutrofilie a trombocytóza nad horní limit normy. Pro skórovací systém podle MSKCC kritérií se jedná o koncentraci laktátdehydrogenázy (LDH) nad 1,5násobek horní hranice normy, hemoglobinu pod dolní hranicí normy, korigovaného sérového kalcia >2,5 mmol/l, Karnofsky index ≤70 % a interval méně než 1 rok od diagnózy do započetí systémové léčby. U modifikovaných MSKCC kritérií je dalším faktorem přítomnost dvou a více postižených orgánů. Podle počtu přítomných pozitivních faktorů se pacient zařazuje do skupiny s dobrou prognózou (žádný faktor), střední (1 nebo 2 faktory) a špatná prognóza (3 a více faktorů).
Doporučené algoritmy léčby metastatického RCC podle České onkologické společnosti ČLS JEP 2020 jsou zobrazeny v tabulce. V závorce je uvedena úroveň doporučení ČOS: Stupeň 1 – založeno na vysokém stupni důkazů, jednotné doporučení ČOS, že léčba je vhodná; stupeň 2A – založeno na nižším stupni důkazů, jednotné doporučení ČOS, že léčba je vhodná; stupeň 2B – založeno na nižším stupni důkazů, doporučení ČOS, že léčba je vhodná; stupeň 3 – založeno na jakémkoliv stupni důkazů, v rámci ČOS není shoda o vhodnosti léčby.
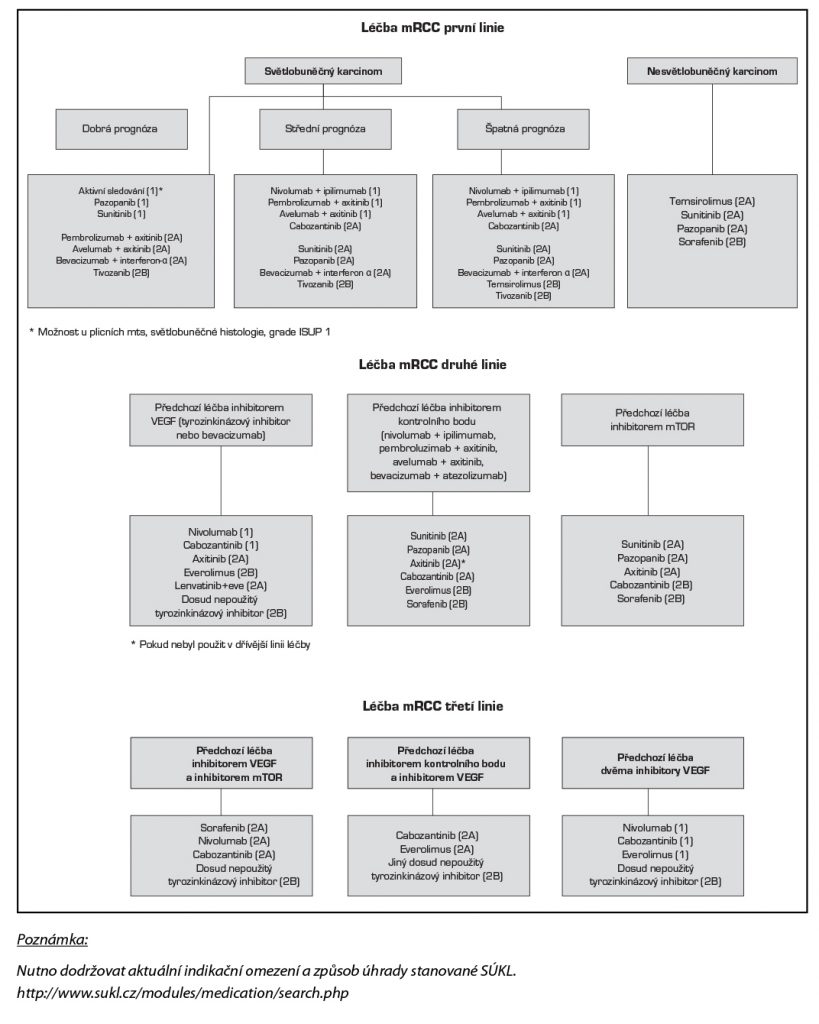
Imunoterapie
Od nespecifické imunoterapie interferonem α (IFN-α) se od objevení cílené terapie upouští, výjimkou je možnost podání v kombinaci s bevacizumabem. V poslední době jsou v popředí zájmu nová imunoterapeutika.
Jedná se o inhibitory receptoru programované buněčné smrti (programmed cell death, PD-1) nivolumab a pembrolizumab, a jeho ligandů (PDL-1) atezolizumab a avelumab. PDL-1 bývají exprimovány na povrchu některých nádorových buněk a navázáním na receptor PD-1 T-lymfocytu jej inaktivují. Cílem blokády tohoto děje je, aby T-lymfocyt zůstal aktivní a zničil nádorovou buňku. Mezi další imunoterapeutika se řadí i antagonisté imunosupresivního receptoru CTLA-4 (cytotoxic T-lymphocyte-associated protein 4), jako je ipilimumab, jenž svým účinkem brání inaktivaci T-lymfocytu.
Nivolumab je v ČR registrován a hrazen pro léčbu druhé a třetí linie u pacientů s progresí při léčbě inhibitory dráhy VEGF. A v kombinaci s ipilimumabem u dospělých pacientů v první linii léčby pokročilého světlobuněčného karcinomu ledviny se střední až špatnou prognózou (s prognostickým skóre podle IMDC o hodnotě 1 – 6).
Jeho indikace pro léčbu RCC se opírá o výsledky randomizované studie fáze III CheckMate-025 z roku 2015, v níž byl porovnáván nivolumab se standardní léčbou druhé linie everolimem u pacientů s progresí na léčbě anti-VEGF. Primárním sledovaným ukazatelem studie bylo hodnocení OS, které pro větev s nivolumabem dosáhlo mediánu 26,0 měsíců a pro větev s everolimem 19,7 měsíců. Nejčastějšími nežádoucími účinky byly únava, teplota a nechutenství. Závažná toxicita se objevovala vzácně.
Indikace nivolumabu v kombinaci s ipilimumabem, se opírá o výsledky studie CheckMate-214 z roku 2018. V této studii byla porovnávána léčba sunitinibem proti kombinaci nivolumab/ipilimumab v první linii léčby. Studie prokázala výrazné zlepšení OS u pacientů se středním a špatným rizikem podle skóre IMDC, kteří byli léčeni kombinací nivolumab/ipilimumab. Medián OS u kombinace imunoterapie nebyl ani po 30měsíčním sledování dosažen (v porovnání s mediánem OS ve větvi se sunitinibem 26,6 měsíce). Ve větvi s nivolumabem/ipilimumabem mělo 11 % pacientů kompletní léčebnou odpověď (CR).
V nové randomizované studii fáze 3, CheckMate 9ER, je hodnoceno použití kombinace nivolumab + kabozantinib proti sunitinibu v první linii u pacientů s pokročilým nebo metastatickým RCC. Podle prvních výsledků studie kombinace nivolumabu s kabozantinibem výrazně zvyšuje PFS (medián 16,6 versus 8,3 měsíců), OS a ORR.
Na konečné výsledky studie si ještě budeme muset počkat.
Při léčbě imunoterapií, zejména u kombinované léčby, je potřeba myslet na riziko rozvoje autoimunitní toxicity.
U nemocných s metastatickým RCC by mělo být vždy přednostně zváženo zařazení do klinické studie.
Závěr
Chirurgická léčba lokalizovaného RCC je zatím jedinou kurativní metodou u pacientů s RCC. V posledních letech se výrazně zlepšila prognóza pacientů s pokročilým a metastatickým RCC díky rozvoji nové biologické léčby a imunoterapie. U některých pacientů při použití imunoterapie došlo dokonce ke kompletní remisi. Jako důležitý faktor v léčbě se jeví výběr sekvence léčiv pro daného pacienta. Léčba RCC je stále v popředí zájmu řady studií, které jsou zaměřeny na porovnání účinnosti, sekvence a zařazení nových léčiv do algoritmu léčby RCC.
MUDr. Eva Strecková
Onkologická klinika 1. LF UK a Thomayerovy nemocnice
