Neuroendokrinní tumory (NET) představují heterogenní skupinu relativně vzácně se vyskytujících nádorů, které vznikají z buněk difuzního neuroendokrinního systému gastrointestinálního traktu (GIT) nebo bronchů. Nejčastěji, asi v 60 – 70 %, se NET vyskytují v GIT jako tzv. gastroenteropankreatické tumory (GEP NET). V České republice jsou NET nejčastěji lokalizovány v oblasti céka (asi třetina pacientů). Klinické příznaky NET, vyvolané hormonální produkcí, představují typický a atypický karcinoidový syndrom.
Vzácný typický karcinoidový syndrom je způsoben vyplavením serotoninu a zahrnuje periferní vasomotorické symptomy hot flushes, sekreční průjmy a někdy i bronchokonstrikci. Naopak častější atypický karcinoidový syndrom vzniká vyplavením jiných mediátorů jako histaminu, bradykininu, prostaglandinu a substance P, a projevuje se déletrvající atakou hot flushes (až desítky minut) a lividním zbarvením kůže. Terapeutický postup u GEP NET se odvíjí od klinického stadia, přičemž u lokalizovaných stadií je chirurgický výkon metodou volby. U pokročilých nebo metastatických nádorů vždy zvažujeme kromě systémové léčby také cytoredukční výkon, ať už chirurgickou resekci, nebo jiné lokální metody jako radiofrekvenční ablaci (RFA), nebo transarteriální chemoembolizaci (TACE). V systémové léčbě se na prvním místě uplatňují somatostatinová analoga. Ty mají účinek jednak antiproliferační, jednak také zmírňují projevy karcinoidového syndromu. V následující části prezentujeme kazuistiku pacientky s NET ilea s primárně metastatickým postižením jater, která byla úspěšně léčena kombinací somatostatinového analoga (Sandostatin LAR) a lokální cytoredukční metodou (TACE). Léčba Sandostatinem LAR však musela být po 9 letech ukončena pro závažné komplikace.
Kazuistika
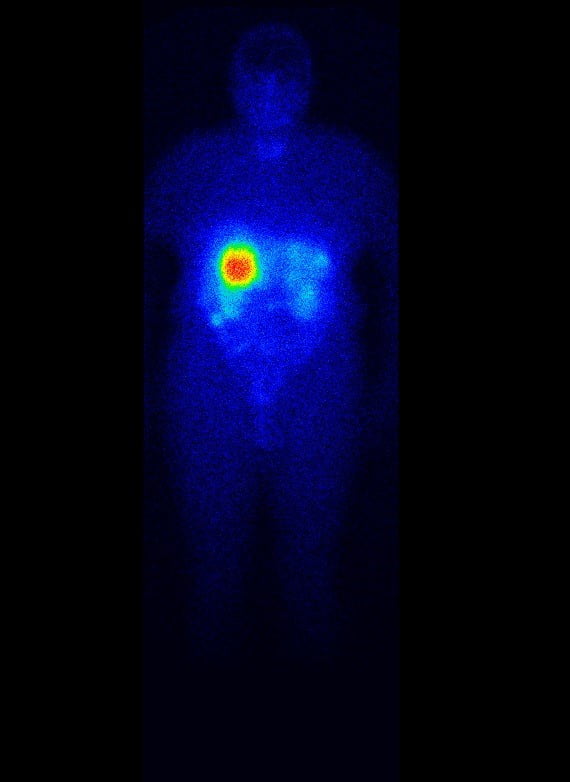
Nyní 75letá pacientka byla v říjnu 2010 hospitalizována na spádovém interním oddělení pro enteroragii. V osobní anamnéze měla pacientka průduškové astma a arteriální hypertenzi, v roce 2007 podstoupila hysterektomii a adnexektomii, a v roce 1996 cholecystektomii. Na CT vyšetření epigastria byl prokázán ložiskový proces jater (jedno ložisko na rozhraní S5 a S7 a druhé ložisko v S6). Endoskopické vyšetření odhalilo drobný benigní polyp jícnu, jenž byl endoskopicky odstraněn, čtyři benigní polypy tlustého střeva a lipom Bauhinské chlopně. Biopsie z jaterního ložiska v dubnu 2011 prokázala dobře diferencovaný neuroendokrinní tumor, pravděpodobně metastatického původu z tenkého střeva. Na kontrolním CT vyšetření břicha v červnu 2011 byla již zachycena i patologická struktura těsně související s lumen tenké kličky, pravděpodobně primum neuroendokrinního tumoru. Laboratorní vyšetření odhalilo zvýšení chromograninu A (CgA) 541,4 ug/l (norma do 50 ug/l) a kyseliny hydroxyindoloctové (HIOK) v moči 710 µmol/den (norma 10,4 – 31,2 µmol/den). Klinicky pacientka trpěla atypickým karcinoidovým syndromem (průjmy, noční návaly horka). Ke kompletizaci stagingu byla doplněna scintigrafie 111 – In pentetreotidem (octreoscan), na níž obě jaterní ložiska zvýšeně akumulovala radiofarmakum, a tedy odpovídala nádorové tkáni s vysokou expresí somatostatinových receptorů (viz obrázek 1).
Vzhledem ke klinickým příznakům byla v červnu 2011 zahájena léčba Sandostatinem LAR v dávce 20 mg měsíčně, jež byla poté pro neuspokojivou kompenzaci karcinoidového syndromu navýšena na 30 mg měsíčně. Nálezy pacientky byly prezentovány na mezioborové komisi pro gastrointestinální tumory, která indikovala resekci tenkého střeva s rozšířenou pravostrannou hemihepatektomií. Před výkonem byla v listopadu 2011 provedena ještě embolizace pravostranné portální žíly. V lednu pacientka podstoupila pravostrannou hemikolektomii s nálezem neuroendokrinního tumoru ilea infiltrujícího vzestupný tračník. Od pravostranné hemihepatektomie bylo nakonec ustoupeno pro nález parciální trombózy portální žíly. Pro inoperabilní nález jaterních ložisek byla indikována transarteriální chemoembolizace (TACE) s doxorubicinem a nadále pokračováno v terapii Sandostatinem LAR.
Od března 2012 do května 2012 pacientka podstoupila celkem třikrát TACE s výsledkem částečné regrese jaterních ložisek, normalizace koncentrace CgA a vymizení karcinoidového syndromu. Stabilizace nemoci trvala až do července 2014, kdy se objevila mírná progrese jedné jaterní léze, proto bylo multidisciplinární komisí indikováno provedení čtvrté TACE v září 2014 s uspokojivým výsledkem stabilizace. V květnu 2016 se na CT trupu objevil nález mírně zvětšených uzlin v dolním mediastinu a retroperitoneu. Koncentrace CgA byla nadále v mezích normy a klinicky byla pacientka asymptomatická, proto bylo pokračováno v terapii Sandostatinem LAR. V červnu 2017 byla pacientka hospitalizována pro obstrukční ikterus, pro který byla provedena endoskopická retrográdní cholangiopankreatografie (ERCP) s nálezem mnohočetné choledocholitiázy. Po extrakci litiázy byl zaveden plastový duodenobiliární stent. Vzhledem ke stabilizaci nemoci se nadále pokračovalo v léčbě Sandostatinem LAR, nyní již v kombinaci s kyselinou ursodeoxycholovou jako prevencí litiázy.
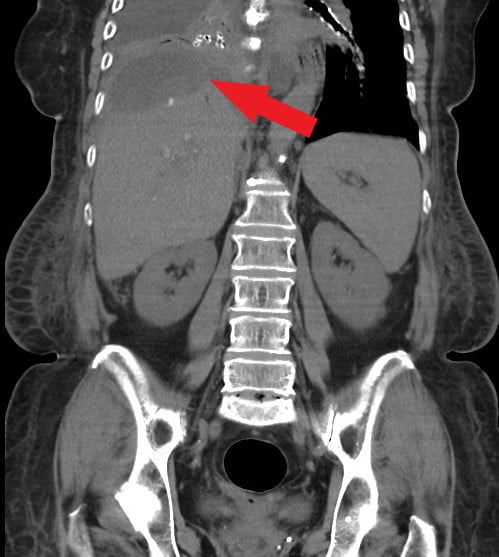
Onemocnění bylo při léčbě Sandostatinem LAR stabilní a pacientka pravidelně podstupovala výměny duodenobiliárního drénu až do února 2020, kdy byla přijata pro závažnou cholangoiditidu, komplikovanou subfrenickým abscesem, při rozsáhlé choledocholitiáze až hepatikolitiáze (viz obrázek 2). Závažná litiáza musela být řešena cholangioskopickým výkonem s litotrypsí ve spolupráci s gastroenterologickou ambulancí ve Fakultní nemocnici u sv. Anny. Po opakovaných endoskopických výkonech s litotrypsí, po drenáži subfrenického abscesu vpravo a po antibiotické terapii se stav pacientky výrazně zlepšil, jaterní funkce i koncentrace bilirubinu se normalizovaly. Vzhledem k závažným nežádoucím účinkům Sandostatinu LAR (choledocholitiáze), která vznikla i přes preventivní terapii kyselinou ursodeoxycholovou, musela být léčba ukončena. Co se týká NET, je pacientka nyní bez onkologické léčby, klinicky asymptomatická, výkonnostní stav nemocné je výborný a podle pravidelných CT vyšetření je onemocnění stabilizováno. Pacientka podstupuje pravidelně výměny duodenobiliárního drénu, a díky novým technickým možnostem cholangioskopie, které zahrnují možnost litotrypse, je nyní drenáž žlučových cest opět funkční s normálními hodnotami jaterních testů.
Závěr
Naše kazuistika ilustruje poměrně častý (≥1/10) nežádoucí účinek léčby Sandostatinem LAR – cholelitiázu, která se může projevit obstrukčním ikterem, cholecystitidou nebo cholangitidou. Na uvedenou komplikaci je nutno vždy pomýšlet a u pacientů zahajujících léčbu Sandostatinem LAR se doporučuje provedení ultrazvukové vyšetření žlučníku k vyloučení litiázy. Pokud se litiáza vyskytne, je nutno zvážit přínos a rizika spojená s další terapií Sandostatinem LAR, protože progrese litiázy může vést k život ohrožujícím komplikacím (hepatikolitiáza, subfrenický absces), stejně jako v případě naší pacientky.
MUDr. Simona Bořilová,MUDr. Jiří Tomášek, Ph.D.
Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
