Karcinom z Merkelových buněk je vzácným maligním nádorem kůže, který zaujímá méně než 1 % všech maligních kožních nádorů. Jedná se o agresivní malignitu, jejíž pětileté přežití se pohybuje mezi 48 a 63 %. Karcinom z Merkelových buněk primárně metastazuje do spádových lymfatických uzlin. Metastatické onemocnění se může rozvinout i v případě klinické absence primárního nádoru v souvislosti s jeho možnou spontánní regresí.
Karcinom z Merkelových buněk (Merkel cell carcinoma – MCC) vykazuje neuroendokrinní imunofenotyp, v literatuře se pro MCC užívá též synonymum primárně kožní neuroendokrinní karcinom. Podle původní představy je histogeneze MCC spatřována ve specifických mechanoreceptorech kůže (Merkelovy buňky). Skutečná histogeneze tohoto nádoru je však dosud diskutovanou otázkou. Kromě Merkelových buněk je zvažován původ tohoto nádoru ve fibroblastech, epiteliálních či B buněčných progenitorových buňkách. Není vyloučeno, že své typické imunofenotypické znaky získává MCC až v průběhu onkogeneze.
Výskyt, projevy a asociace s jiným onemocněním
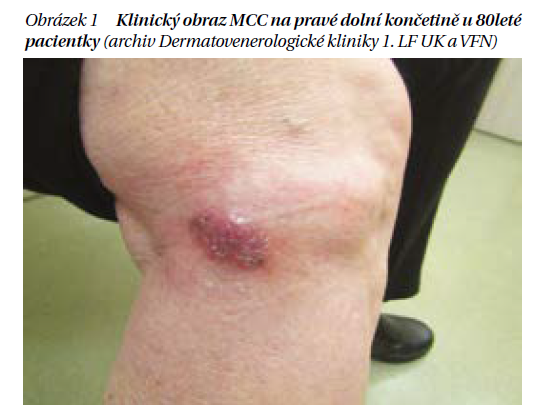
MCC se nejčastěji projevuje jako rychle rostoucí nodulus barvy kůže, vznikající obvykle v oblastech exponovaných slunci, který může zůstat klinicky nepovšimnut. Vyšší výskyt MCC je zaznamenán u mužů vyššího věku, prokázaný vliv má imunosuprese včetně infekce HIV. Charakteristické vlastnosti MCC jsou v anglojazyčné literatuře shrnovány do mnemotechnické pomůcky AEIOU (A – asymptomatic, E – expanding rapidly, I – immunosupression, O – older than 50 years, U – ultraviolet).
Dobře dokumentovaná je asociace MCC a hematoonkologických onemocnění. Hlavní roli zde pravděpodobně hraje imunosuprese. Pacienty s MCC a současným hematoonkologickým onemocněním (nejčastěji CLL/SLL) jsou častěji muži a predilekčními lokalitami vzniku MCC u těchto pacientů je překvapivě kůže neexponovaná slunečnímu záření (např. hýždě).
Popsány jsou dva subtypy MCC – MCC asociovaný s UV zářením a MCC asociovaný s tzv. Merkel Cell Polyomavirus (MCPyV), který zaujímá asi 80 % všech případů MCC. MCPyV + MCC vykazuje lepší prognózu nežli MCPyV- MCC. Detekce MCPyV je možná jak molekulárněgenetickou analýzou, tak imunohistochemicky.
Histopatologie
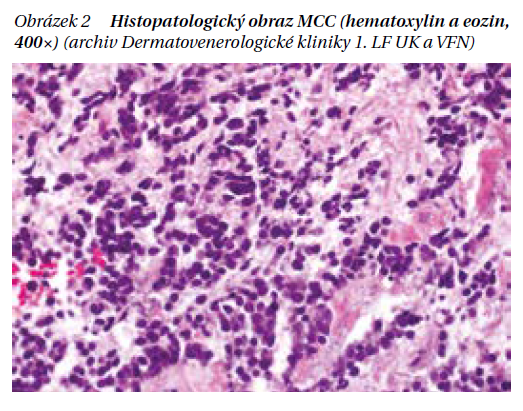
Histopatologicky je MCC charakterizován nádorovými noduly infiltrujícími korium a případně i podkožní tukovou tkáň. Vzhledem k vysokému lymfangiotropismu MCC je při histopatologickém vyšetření hojně přítomna lymfovaskulární invaze, a to i v oblastech relativně vzdálených primárnímu nádoru.
Imunohistochemicky je v buňkách MCC prokazována tečkovitá cytoplazmatická pozitivita cytokeratinů (včetně cytokeratinu 20) a markerů neuroendokrinní diferenciace (synaptofyzin, chromogranin, CD56, INSM1).
Na základě klinických a histopatologických charakteristik jsou MCC rozdělovány na low-risk a high-risk. Jakákoli z následujících vlastností klasifikuje MCC jakožto high-risk: nádor velikosti ≥ 2 cm, lokalita na hlavě či krku, lymfovaskulární invaze, chronický imunosupresivní stav a pozitivní sentinelová lymfatická uzlina (viz dále).
Doporučení pro léčbu pacientů s MCC a jejich další sledování
Doporučení pro management MCC jsou přejata z guidelines vypracovaných Evropskou asociací dermatoonkologie (European Association of Dermato-Oncology – EADO).
Léčebnou metodou volby je široká excize primárního nádoru s bezpečnostním lemem přibližně 1 cm. Vzhledem k vysoké radiosenzitivitě MCC by měla následovat adjuvantní radioterapie oblasti jizvy v horizontu maximálně 8 týdnů po resekci. Bylo zjištěno, že s každým týdnem odložení adjuvantní radioterapie se zvyšuje riziko relapsu.
Absence klinických či radiologických známek generalizace je indikací k mapování sentinelové lymfatické uzliny. V případě její pozitivity by měla být užita adjuvantní radioterapie spádové oblasti, případně kompletní lymfadenektomie kombinovaná s radioterapií.
Při makroskopickém postižení regionálních lymfatických uzlin je doporučována kompletní lymfadenektomie. Následnou adjuvantní radioterapii je možno individuálně zvážit. Radioterapie má v léčbě MCC své postavení i v případech, kdy není chirurgické řešení z různých důvodů indikováno.
Pacienta po resekci MCC je doporučováno sledovat v prvních 3 letech každých 3–6 měsíců včetně sonografického vyšetření jizvy po primárním nádoru a spádových lymfatických uzlin. V dalších letech je možno kontroly plánovat v horizontu à 12 měsíců. U pacientů s vysokým rizikem (zejména po resekci onemocnění stadia III či imunosuprimovaných) je doporučeno intervaly kontrol individuálně zkrátit.
První volbou v léčbě metastazujícího MCC je imunoterapie avelumabem
Avelumab je plně humánní monoklonální protilátka třídy IgG1, která je vyráběna technologií rekombinantní DNA v suspenzní kultuře ovariálních buněk křečíka čínského.
Cílovým antigenem avelumabu je ligand receptoru PD-1 (PD-L1). Receptor PD-1 je exprimován na membráně různých subtypů T lymfocytů. Za normálních podmínek dochází při navázání receptoru PD-1 na jeho ligandy PD-L1 či PD-L2, exprimované na antigen prezentujících i nádorových buňkách, k inhibici funkce T lymfocytů. Při selektivní blokaci PD-L1 monoklonální protilátkou je tento inhibiční signál přerušen, a tím dochází k posílení protinádorové aktivity imunitního systému závislé na T lymfocytech. Posilována je jejich proliferace, cytotoxická aktivita a sekrece cytokinů. V případě avelumabu byla navíc prokázána indukce přímého rozpadu nádorových buněk prostřednictvím NK buněk na podkladě buněčné cytotoxicity závislé na protilátkách (antibody-dependent cellular cytotoxicity – ADCC). Průběh léčebné odpovědi a spektrum nežádoucích účinků avelumabu jsou do velké míry analogické jiným imunoterapeutikům, která blokují signální dráhu PD-1/PD-L1.
Terapeutický efekt a bezpečnost avelumabu
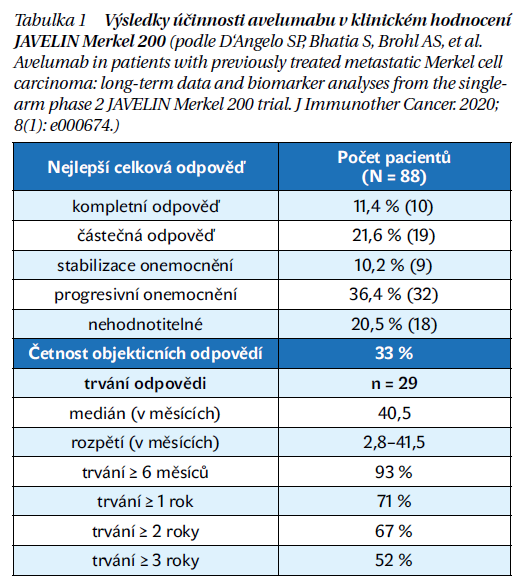
U pacientů s metastazujícím MCC, u kterých došlo k progresi po předchozí chemoterapii, byl terapeutický efekt a bezpečnost avelumabu hodnocen v klinickém hodnocení JAVELIN Merkel 200. Jednalo se o otevřenou multicentrickou studii fáze II, do níž bylo zařazeno celkově 88 pacientů. Průměrný věk pacientů byl 72,5 roku (od 33 do 88 let), výrazně převažovali muži (73,9 %). Z celkového počtu 88 pacientů mělo 67 z nich primární lokalizaci MCC na kůži, u zbytku pacientů se MCC vyskytoval mimo kůži nebo nebyl primární nádor nalezen. Stran předchozí léčby mělo 52 pacientů jednu předchozí systémovou léčbu, 25 pacientů dvě předchozí linie systémové léčby a zbytek pacientů minimálně tři linie systémové léčby. Klinické hodnocení mělo pouze jedno rameno, v němž byli pacienti léčeni avelumabem v dávce 10 mg/kg každé 2 týdny. Primárním sledovaným ukazatelem byla celková četnost odpovědí, potvrzená podle radiologických kritérií RECIST (Response Evaluation Criteria in Solid Tumors). Dalšími hodnocenými ukazateli bylo trvání léčebné odpovědi, přežití bez progrese a celkové přežití. Četnost objektivních léčebných odpovědí dosáhla 33 %. Kompletní výsledky účinnosti shrnuje tabuka 1. Léčba avelumabem prokázala prodloužení léčebných odpovědí, naprostá většina pacientů (93 %) si udržela léčebný efekt po dobu více než 6 měsíců.
Avelumab byl pro léčbu metastazujícího MCC schválen FDA (Food and Drug Administration) v březnu 2017. V Evropě schválila EMA (European Medicines Agency) avelumab v září 2017. V České republice je avelumab podle aktuálního indikačního omezení SÚKL (informace k dubnu 2024) hrazen v monoterapii v první linii léčby u dospělých pacientů starších 18 let s metastazujícím karcinomem z Merkelových buněk (klinického stadia IV). Pacienti musí splnit obecné podmínky, jako je výkonnostní status 0–1 podle ECOG, příznivé výsledky laboratorního vyšetření, absence závažného aktivního autoimunitního onemocnění či intersticiální plicní choroby a nepřítomnost klinické symptomatologie mozkových metastáz či jejich adekvátní ošetření. Tato omezení jsou analogická podmínkám při podávání jiných imunoterapeutik.
Léčba avelumabem je hrazena do progrese onemocnění (která je verifikovaná opakovaným CT vyšetřením v odstupu 4–8 týdnů z důvodu vyloučení tzv. pseudoprogrese) a/nebo neakceptovatelné toxicity. Maximální doba terapie avelumabem není stanovena. Avelumab se aplikuje v plošné dávce 800 mg v intravenózní infuzi trvající 60 minut každé 2 týdny. Premedikace před aplikací avelumabu užitím perorálního antihistaminika a paracetamolu je podle SPC vyžadována u prvních 4 dávek. V případě absence reakce v souvislosti s podáním infuze není premedikace u dalších dávek avelumabu požadována a její potřebu je možno individuálně zvážit.
Při terapii avelumabem je nutná monitorace jaterních a renálních funkcí, krevního obrazu včetně diferenciálního počtu, hormonů štítné žlázy a ranního kortizolu k časnému záchytu případné toxicity.
Možné nežádoucí účinky léčby
Nežádoucí účinky avelumabu jsou imunitně zprostředkované (immune-related adverse events – irAEs) a svým charakterem se v principu neliší od nežádoucích účinků jiných imunoterapeutik inhibujících signální dráhu PD-1/PD-L1.
Jejich grading a management se zakládají na kritériích CTCAE v5.0 (Common Terminology Criteria for Adverse Events, verze 5.0) z roku 2017. Hodnocení je pětistupňové, přičemž stupeň 5 značí fatální AE.
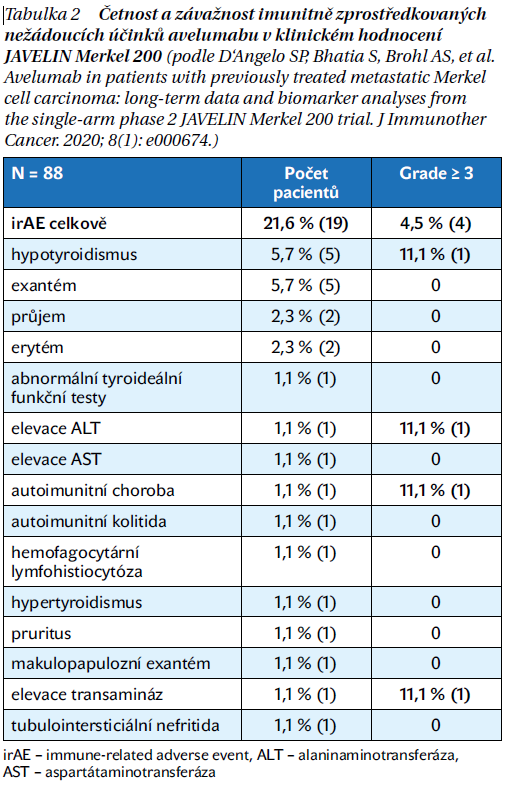
Četnost a závažnost nežádoucích účinků avelumabu byla hodnocena ve výše zmíněném klinickém hodnocení JAVELIN Merkel 200, výsledky shrnuje tabulka 2. Z hlediska četnosti byl u avelumabu nejčastěji identifikován hypotyroidismus (v 5,7 %) a kožní toxicita ve formě exantému, erytému či pruritu. Pouze jednotlivé případy popsaly elevaci jaterních enzymů, kolitidu a nefritidu.
Velmi vzácnými příklady irAEs zjištěnými v průběhu léčby avelumabem byla neurologická toxicita ve formě myasthenia gravis, Guillainova–Barrého syndromu či periferní neuropatie a revmatologická toxicita ve formě artralgií či artritidy.
Vzácně se při aplikaci imunoterapie včetně avelumabu objevují případy reakcí spojených s podáním infuze. Nejčastějšími symptomy jsou pyrexie, nauzea, zvracení, bolest břicha, zimnice a návaly horka.
Zvládání irAEs při léčbě avelumabem se v zásadě neliší od managementu irAEs při léčbě jinými imunoterapeutiky, která inhibují signální dráhu PD-1/PD-L1.
Redukce dávky monoklonální protilátky se při výskytu nežádoucího účinku nedoporučuje. Uplatňuje se přerušení léčby či úplné vysazení léku v závislosti na závažnosti nežádoucí příhody. Každý pacient by měl být vybaven příručkou a kartičkou pacienta s názvem léku a nejčastějšími imunitně zprostředkovanými nežádoucími účinky, kartičku by měl nosit stále u sebe pro případ neočekávané potřeby. Pacienti by měli být v průběhu aplikace infuze pod dohledem personálu z důvodu možné reakce spojené s podáním infuze.
V případě selhání imunoterapie avelumabem, její intolerance či kontraindikace je v další linii léčby metastazujícího MCC ke zvážení systémová chemoterapie. Užívána je nejčastěji kombinace platinových derivátů a etoposidu.
MUDr. Miroslav Důra, Ph.D.
Dermatovenerologická klinika 1. LF UK a VFN v Praze
