Léčba akutní lymfoblastické leukemie v posledním desetiletí doznala pokroku v podobě zavedení několika nových léků a léčebných postupů. Pro pacienty s relapsem ALL jsou k dispozici monoklonální protilátky, imunokonjugáty a zcela nová léčebná modalita v podobě lymfocytů s chimérním antigenním receptorem (CAR T lymfocyty). Tyto léky se v rámci klinických hodnocení zkoušejí i pro léčbu nově diagnostikovaných pacientů, u kterých vykazují vynikající léčebné výsledky.
Akutní lymfoblastická leukemie (ALL) je maligní klonální onemocnění krvetvorby vycházející z prekurzorových buněk B lymfoidní (B-ALL) nebo T lymfoidní (T-ALL) řady. B-ALL je asi 3× častější než T-ALL. Jedná se o nejčastější onkologické onemocnění v dětském věku s incidencí 3–4/100 000 dětí ročně a maximem výskytu mezi 2 a 5 lety věku. U dospělých se toto onemocnění řadí mezi vzácné malignity, ve věkové skupině nad 18 let postihne asi 1,0–1,6/100 000 obyvatel ročně. Častou rekurentní genetickou aberací přítomnou asi u čtvrtiny dospělých pacientů s B-ALL především staršího věku je fúzní gen BCR::ABL1 dávající vznik tzv. filadelfskému chromozomu s translokací t(9;22). Tato varianta B-ALL je nazývána BCR::ABL1 pozitivní nebo Ph pozitivní ALL. Formu onemocnění s uzlinovým syndromem a nízkou infiltrací kostní dřeně pod 25 % označujeme jako lymfoblastický lymfom (LBL), téměř výhradně vycházející z T linie.
Léčba nově diagnostikované ALL
V léčbě ALL jsou používány kombinované režimy obsahující antracykliny, vinka alkaloidy, cyklofosfamid, cytarabin, methotrexát, 6-merkaptopurin a kortikoidy. Standardní součástí intenzivních protokolů je rovněž enzym asparagináza (nejčastěji v pegylované formě), který deplecí asparaginu blokuje proteosyntézu v lymfoidních prekurzorových buňkách. U pacientů s pozitivitou antigenu CD20 na povrchu leukemických blastů je přidávána do kombinace monoklonální protilátka ritruximab. Léčba se standardně skládá z chemoterapie indukční (asi 2 měsíce), několika cyklů chemoterapie konsolidační (6–10 měsíců) a chemoterapie udržovací (1–2 roky). U vysoce rizikových pacientů nebo pacientů s neoptimální léčebnou odpovědí jsou podávány jen 1–2 cykly konsolidační chemoterapie následované alogenní transplantací krvetvorných kmenových buněk (aloSCT). U pacientů s infiltrací centrální nervové soustavy (CNS) nebo přetrvávajícím PET-avidním tumorem mediastina je používána radioterapie postižené oblasti (obrázek 1).
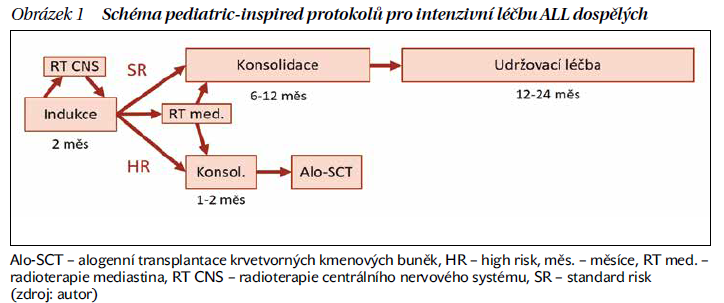
Se zavedením léčebných protokolů inspirovaných pediatrickými režimy v devadesátých letech minulého století sice prognóza dospělých pacientů zaznamenala výrazné zlepšení, výsledky jsou však stále neuspokojivé. Výsledky nejnovějšího protokolu německé pracovní skupiny GMALL 08/2013 pro pacienty do 55 let byly publikovány v roce 2021. Při této léčbě dosáhlo 93 % pacientů kompletní hematologické remise (CR) a 76 % pacientů 3letého celkového přežití (OS). Nemocní ve věkové skupině 55–70 let dosahují při léčbě klasickou chemoterapií 3letého OS ve 20 % a pacienti léčení paliativně mají velmi špatnou prognózu s přežitím v řádu týdnů až několika málo měsíců. Další intenzifikace chemoterapeutických režimů již pravděpodobně nemá potenciál vést k lepším výsledkům, naopak by vedlo jen k nepřiměřenému narůstání toxicity. Východiskem z této situace by mohlo být zařazení nových cílených léků do časných fází léčby ALL.
Minimální reziduální nemoc
O léčbě ALL se v současnosti již nelze bavit bez zmínění minimální reziduální nemoci (MRN). Tímto pojmem rozumíme přetrvávající leukemickou infiltraci v kostní dřeni nebo periferní krvi, která není detekovatelná pomocí morfologických metod. Pomocí průtokové cytometrie je možno detekovat MRN na úrovni 1,0 × 10–3 až 1,0 × 10–4 buněk. Nejcitlivější metodou pro detekci MRN je PCR s rozlišovací schopností 1,0 × 10–4 až 1,0 × 10–5 buněk.
Přetrvávající MRN po ukončení indukční fáze léčby je nejvýznamnějším negativním prognostickým faktorem u ALL a indikací k intenzifikaci léčby. Naopak časné dosažení kompletní molekulární remise (CMR), tedy nedetekovatelné MRN pomocí PCR, je prognosticky příznivým faktorem. Znovuobjevení detekovatelné MRN po předchozí CMR, tzv. molekulární relaps, je v podstatě vždy následováno relapsem hematologickým, a je tedy indikací k časnému zahájení záchranné terapie relapsu.
Léčba relabující/refrakterní B-ALL
Blinatumomab
Bispecifická anti-CD19/anti-CD3 monoklonální protilátka blinatumomab je v ČR používána v léčbě relapsu B-ALL od roku 2016. Tato molekula se jedním epitopem váže na CD19 leukemického blastu a druhým epitopem na CD3 zdravého cytotoxického T lymfocytu, který je touto vazbou aktivován a blast zničí (obrázek 2). Asi 67 % pacientů s relabující/refrakterní B-ALL dosáhne touto léčbou CR, velká část z nich i CMR, což umožní s vysokou úspěšností následně provést aloSCT. Lék se podává kontinuální infuzí přenosnou pumpou trvající 28 dní. Specifickými nežádoucími účinky blinatumomabu jsou syndrom z uvolnění cytokinů, reverzibilní neurotoxicita s nejrůznějšími lokálními i celkovými projevy a deplece zdravých B lymfocytů s nutností substituce imunoglobulinů. Infekční komplikace jsou ale mnohem méně časté než při standardní chemoterapii.
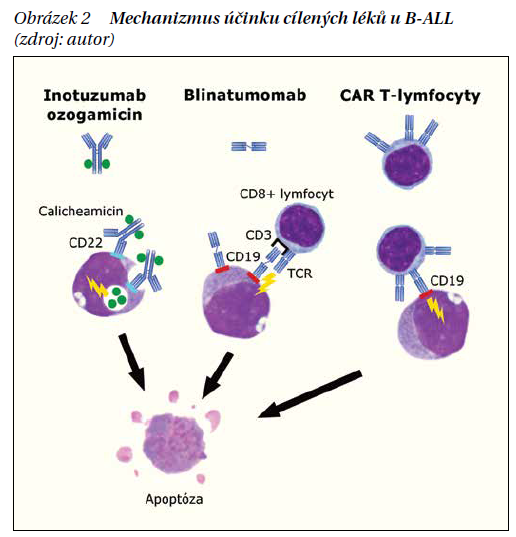
Blinatumomab je aktuálně v léčbě dospělých indikován jako monoterapie pro (1) relabující/refrakterní Ph negativní B-ALL, (2) relabující/refrakterní Ph pozitivní B-ALL po selhání alespoň dvou tyrozinkinázových inhibitorů nebo (3) molekulární relaps/přetrvávající MRN pozitivitu >1,0 × 10–3. Výši úhrady z veřejného zdravotního pojištění má ale v ČR stanovenou jen pro poslední ze zmíněných indikací.
Inotuzumab ozogamicin
Imunokonjugát monoklonální protilátky anti-CD22 a cytostatika kalicheamicinu inotuzumab ozogamicin je v ČR dostupný od roku 2017. Účinností se podobá předchozímu léku, cca 63 % pacientů s relabující/refrakterní B-ALL dosáhne CR, počet CMR je také vysoký. Mezi specifické nežádoucí účinky této léčby patří elevace bilirubinu, jaterních transamináz, venózní okluzivní choroba jater a rovněž deplece zdravých B lymfocytů.
Inotuzumab ozogamicin je v ČR indikován v monoterapii (1) relabující/refrakterní Ph negativní B-ALL nebo (2) relabující/refrakterní Ph pozitivní B-ALL po selhání alespoň jednoho tyrozinkinázového inhibitoru. Výši úhrady z veřejného zdravotního pojištění má ale v ČR stanovenou jen pro první ze zmíněných indikací.
Ph pozitivní ALL a tyrozinkinázové inhibitory
V našich podmínkách je standardem první linie léčby mladších pacientů s Ph pozitivní ALL přidání imatinibu k chemoterapii s redukovanou intenzitou a po dosažení CR provedení aloSCT. Přidání imatinibu k chemoterapii u nemocných výrazně zvýšilo počet dosažených CR a dlouhodobé přežití. Při relapsu Ph pozitivní ALL je často přítomna některá z mutací domény ABL1 měnící vazebné místo pro molekulu imatinibu. Většinu z těchto mutací lze překonat některým z tyrozinkinázových inhibitorů (TKI) 2. generace: dasatinibem, nilotinibem či bosutinibem, přičemž pro léčbu ALL má schválenou indikaci pouze dasatinib. Jediný zástupce TKI 3. generace ponatinib je pak vyhrazen pro selhání či intoleranci léčby TKI 2. generace a/nebo při přítomnosti mutace T315I domény ABL1, která je rezistentní na léčbu všemi ostatními preparáty TKI. Rovněž u relabující/refrakterní Ph pozitivní ALL jsou TKI podávány většinou v kombinaci s cytostatickou chemoterapií. Mezi nežádoucí účinky imatinibu patří nevolnost, průjmy, cefalea, cytopenie či periorbitální edémy, většinou je však snášen velmi dobře. Dasatinib může u některých pacientů vyvolávat pleurální výpotky a ponatinib je specifický svojí kardiální a pankreatickou toxicitou. Výši úhrady z veřejného zdravotního pojištění pro Ph pozitivní ALL má v ČR stanovenu jen ponatinib.
CAR T lymfocyty
T lymfocyty s chimérním antigenním receptorem (chimeric antigen receptor T-cells – CAR T lymfocyty) jsou lymfocyty odebrané z periferní krve pacienta, do kterých je in vitro (nejčastěji pomocí virového vektoru) vpraven gen pro chimérní T buněčný receptor se specificitou proti jednomu z povrchových antigenů nádorové buňky, u B-ALL většinou CD19. Po kultivaci jsou takto modifikované CAR T lymfocyty infuzí aplikovány nemocnému. V těle pacienta dojde k proliferaci CAR T lymfocytů a imunitní reakci namířené proti nádorové buněčné populaci (obrázek 3). Před samotnou aplikací CAR T lymfocytů je podávána lymfodepleční chemoterapie, která zlepšuje proliferaci a expanzi CAR T lymfocytů v těle pacienta.
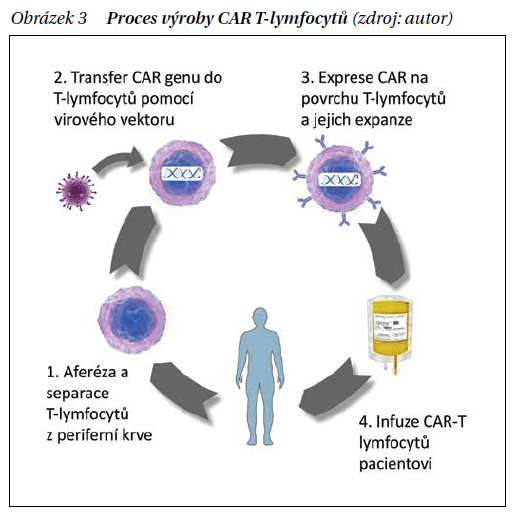
Tato nová metoda léčby je již dnes využívána u řady B lymfoproliferativních malignit – B-ALL, difuzního velkobuněčného B lymfomu, lymfomu z plášťových buněk, folikulárního lymfomu či mnohočetného myelomu. Mezi hlavní projevy toxicity léčby CAR T lymfocyty patří podobně jako u blinatumomabu syndrom z uvolnění cytokinů, zde ale obecně s těžším průběhem nezřídka vyúsťujícím v multiorgánové selhání. Dalšími komplikacemi jsou neurotoxicita, pancytopenie, deplece zdravých B lymfocytů s hypogamaglobulinemií a infekční komplikace. Výsledky léčby CAR T lymfocyty jsou ale i přes to povzbuzující – 70–85 % navozených kompletních remisí u těžce předléčených pacientů s refrakterní/relabující ALL. Předpokladem úspěšné léčby a trvající CR je ale při léčbě CAR T lymfocyty následné provedení aloSCT.
Pro léčbu B-ALL je v ČR schválen od roku 2018 preparát tisagenlekleucel. Je indikován u pacientů do 25 let s B-ALL, která je refrakterní, v relapsu po transplantaci nebo ve druhém nebo pozdějším relapsu. V USA je od roku 2021 pro pacienty s B-ALL starší 25 let dostupný preparát brexucabtagene autoleucel, v ČR má zatím indikaci jen pro lymfom z plášťových buněk.
Léčba relabující/refrakterní T-ALL/LBL
Vývoj nových léků pro T-ALL/LBL bohužel není z daleka tak úspěšný jako u B-ALL. Již od roku 2007 je pro léčbu refrakterní/relabující T-ALL/LBL dostupný purinový analog nelarabin. Navodí CR u 31–36 % refrakterních/relabovaných pacientů, což je oproti klasické záchranné chemoterapii určité zlepšení. Nelarabin byl testován i v kombinaci s dalšími cytostatiky, avšak cenou za vyšší účinnost bylo zvýraznění toxicity. V ČR je nelarabin indikován k léčbě R/R T-ALL až po selhání standardní záchranné chemoterapie. Výši úhrady z veřejného zdravotního pojištění stanovenu nemá. V klinických hodnoceních se zkouší několik dalších potenciálních léků pro T-ALL/LBL, např. daratumumab, navitoklax či venetoklax.
Závěr
Pro léčbu B-ALL máme již několik let k dispozici nové účinné cílené léky blinatumomab a inotuzumab ozogamicin. Pro pediatrické a mladší dospělé pacienty s agresivním onemocněním je k dispozici nákladná, ale vysoce účinná léčba CAR T lymfocyty. Tyrozinkinázové inhibitory 2. a 3. generace otvírají možnosti léčby pro refrakterní/relabující pacienty s Ph pozitivní ALL i ve starším věku. Možnosti léčby refrakterní/relabující T-ALL/LBL jsou oproti léčbě B-ALL ale stále omezené a její výsledky neuspokojivé.
MUDr. Štěpán Hrabovský, Ph.D.
Interní hematologická a onkologická klinika, LF MU a FN Brno
